常见的碱
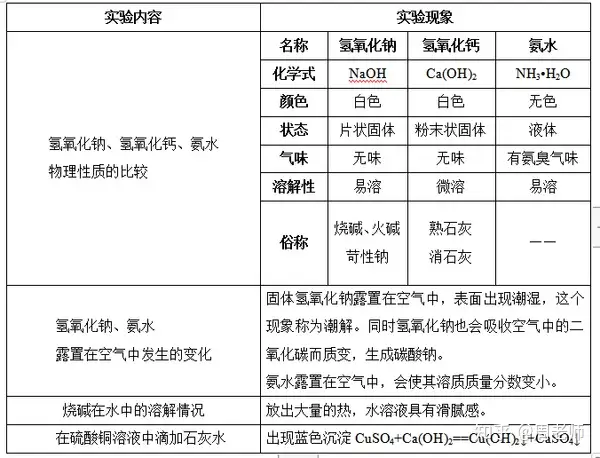
1.有关碱的一些性质比较
烧碱具有强腐蚀性,氢氧化钙和氨水也具有一定的腐蚀性。
氢氧化钠溶液能够与头发、鸡蛋清、植物油等发生化学反应,溶解其中的蛋白质。
2.碱的共同性质
由于碱电离后都能生成OH-,因此也具有相同的性质(碱的四大通性):
如:NaOH == Na++ OH-;NH3•H2O == NH4++OH-;
(1)与酸碱指示剂作用
A.紫色石蕊试剂或红色石蕊试纸遇到碱溶液变蓝;
B.无色酚酞遇到碱溶液变红。
(2)与某些非金属氧化物反应(非金属氧化物又称酸性氧化物)
碱溶液+ 非金属氧化物→ 盐+ 水
如:2NaOH + CO2== Na2CO3+ H2O;Ca(OH)2+ SO2== CaSO3↓+ H2O;
(3)与酸溶液的反应
碱+酸→盐+水
(4)能与某些盐反应
碱溶液+ 盐溶液→ 新盐+ 新碱
如:CuSO4+ 2NaOH == Na2SO4+ Cu(OH)2↓Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
3.复分解反应:有两种化合物相互交换成分,生成另外两种化合物的反应。
可以用:AB + CD == AD + CB 表示。
特点:(1)反应物、生成物均只有两种化合物;
(2)发生反应的两种化合物相互交换成分;
(3)各元素的化合价在反应前后均不改变。
注:难溶性碱受热易分解(不属于碱的通性)
(责任编辑:admin)
|