2023年初中化学酸碱盐的知识点总结和学习
http://www.newdu.com 2025/12/12 06:12:18 中考网 佚名 参加讨论
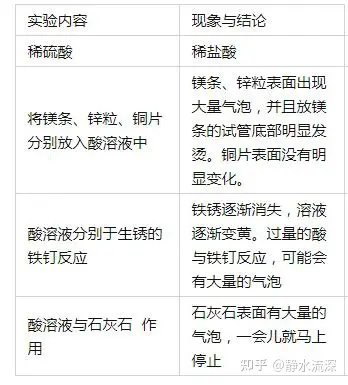
溶液的酸碱性 一、酸性溶液和碱性溶液 1.酸性溶液、碱性溶液和指示剂的反应:
结论: (1)凡是能使紫色石蕊试液变红的溶液都是酸性溶液,且该溶液不能使无色酚酞试液变色; (2)凡是能使紫色石蕊试液变蓝的溶液都是碱性溶液,并且该溶液能使无色酚酞试液变红; (3)不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为中性溶液; (4)紫色石蕊试液和酚酞能检验溶液酸碱性的试剂,我们称为酸碱指示剂。 注意: ①酸性溶液能使蓝色石蕊试纸变红,碱性溶液能使红色石蕊试纸变蓝; ②只有可溶性的酸性、碱性物质才能使指示剂变色,变色的是指示剂,而不是该物质,而且这酸碱和指示剂的反应属于化学变化。 2.日常生活中常见的酸性物质与碱性物质 (1)酸性物质:山楂、柠檬、柑橘、西红柿,食醋等; (2)碱性物质:熟石灰,碳酸钠等。 3.区分酸溶液和酸性溶液、碱溶液和碱性溶液 注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。 例如:硫酸铜、氯化铵,硫酸氢钠的水溶液显酸性,而不是酸;纯碱、肥皂的水溶液显碱性,但不是碱。 4.酸、碱、盐的概念 (1)酸:电离时生成的阳离子全部是氢离子的化合物。如:HCl、HNO3、H2SO4、H2CO3等。 HCl= H+ + Cl-(一元酸);H2SO4= 2H++SO42-(二元酸); (2)碱:电离时生成的阴离子全部是氢氧根离子的化合物。如:NaOH、Ca(OH)2等。 NaOH = Na+ + OH-(一元碱);Ca(OH)2 = Ca2+ + 2OH-(二元碱); (3)盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物。如:NaCl、NH4NO3等。 NaCl = Na+ + Cl-; NH4NO3 = NH4+ + NO3-; 二、溶液的酸碱性的强弱 1.酸碱度:用来表示溶液的酸性或碱性的强弱程度。 2.pH试纸用来定量的测定溶液的酸碱度。
注意:浓硫酸具有一定的特性: (1)吸水性(物理性质)用于气体干燥,但除NH3等碱性气体除外,对应的化学方程式为:2NH3 + H2SO4 ==(NH4)2SO4; (2)脱水性(化学性质)—浓硫酸与蔗糖反应,使之炭化; (3)强氧化性,腐蚀性——与金属发生反应,生成的气体不生成氢气而是二氧化硫。 在信息题目中个,有时候我们会遇到这样的题目:在加热的条件下,能与排在氢后面的金属(如Cu)反应,如:
(4) 酸 + 碱= 盐 + 水(又称为中和反应,反应类型:复分解反应) 注意:有盐和水的生成不一定是中和反应,如CO2+Ca(OH)2=CaCO3↓+H2O ; (5)酸+盐=新酸+新盐 注意: A.我们通常遇到的盐是碳酸盐,因此绝大部分反应是: 酸 + 碳酸盐 =新盐 + 水 + 二氧化碳,依然是复分解反应; 如: CaCO3 + 2HCl =CaCl2 + H2O + CO2↑; Na2CO3 + H2SO4 =Na2SO4 + H2O + CO2↑; K2CO3 + 2HNO3 =2KNO3 + H2O + CO2↑; MgCO3 + 2CH3COOH = (CH3COO)2Mg + H2O + CO2↑; B.某些特殊的盐能与酸反应,生成特殊的沉淀,需要记忆沉淀 如: HCl + AgNO3 == AgCl↓+ HNO3 ; BaCl2 + H2SO4 == BaSO4↓+ 2HCl. 补充: Cl-及SO42-的检验 A.向待测溶液中加入AgNO3溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有Cl-,如果没有沉淀或者沉淀消失,则不含有Cl-; B.向待测溶液中加入Ba(NO3)2溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有SO42-,如果没有沉淀或者沉淀消失,则不含有SO42-。 三、常见的碱
1.有关碱的一些性质比较 烧碱具有强腐蚀性,氢氧化钙和氨水也具有一定的腐蚀性。 2.碱的共同性质(由于碱电离后都能生成OH-,因此也具有相同的性质) 四、碱的四大通性: 首先了解,碱的电离,如: NaOH = Na+ + OH-; NH3•H2O = NH4+ + OH-(NH3溶于水,滴加酚酞变红的原因); (1)与酸碱指示剂作用 A.紫色石蕊试剂遇到碱溶液变蓝; B.无色酚酞遇到碱溶液变红。 (2)碱溶液 + 非金属氧化物 → 盐 + 水(非金属氧化物又称酸性氧化物,该反应不是复分解反应) 如: 2NaOH + CO2 = Na2CO3 + H2O; Ca(OH)2 + SO2 = CaSO3↓ + H2O; (3)碱 + 酸 = 盐 + 水 (4)碱 + 盐 = 新盐 + 新碱 如: CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓; Ca(OH)2+Na2CO3=2NaOH+CaCO3↓(工业制碱法,纯碱制烧碱); 3.复分解反应:有两种化合物相互交换成分,生成另外两种化合物的反应。 反应表达式:AB + CD =AD + CB 表示。 特点:(两两交换,价态不变) (1)反应物、生成物均只有两种化合物; (2)发生反应的两种化合物相互交换成分; (3)各元素的化合价在反应前后均不改变。 注:难溶性碱受热易分解(不属于碱的通性) ■ 几种重要的盐 一、盐 1.盐的分类:依据组成盐的阳离子和酸根的种类进行分类 根据阳离子的不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。(氯化钠为钠盐) 根据酸根的不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等。(氯化钠为盐酸盐) 2.酸、碱、盐的溶解性规律: ①酸都溶;②溶碱有五位:钾、钠、铵、钙、钡;③钾盐、钠盐、铵盐、硝酸盐都可溶;④盐酸盐只有氯化银不可溶;⑤硫酸盐只有硫酸钡不可溶;⑥碳酸盐只溶钾、钠、铵,剩下都不溶。 注意:AgCl、BaSO4不仅不溶于水,而且不溶于稀硝酸。 10种常见沉淀: AgCl↓、BaSO4↓:不和酸反应; 以下的沉淀都和酸反应: Cu(OH)2↓:蓝色沉淀; F e(OH)3↓:红褐色沉淀; 其余的沉淀都是白色: BaCO3↓、CaCO3↓:和酸反应,产生气体,气体能使澄清石灰水变浑浊; Zn(OH)2↓、Mg(OH)2↓、Fe(OH)2↓、Al(OH)3; 3.盐的化学性质: (1)盐 + 金属 =新盐 + 新金属(置换反应) 在金属活动性顺序表中,除非常活泼的金属K、Ca、Na之外,排在前面的金属一般可以将位于其后面的、比它不活泼的金属从它们的盐溶液中置换出来,如: Zn + CuSO4 = ZnSO4 + Cu; Cu + 2AgNO3 = 2Ag + Cu(NO3)2; (2)盐+碱 = 新盐+新碱 如: CuSO4 + Ca(OH)2 = Cu(OH)2↓ + CaSO4;(CuSO4 和 Ca(OH)2 配置农药波尔多液) (3)盐+酸 = 新盐+新酸 Na2CO3+2HCl ==2NaCl+H2O+CO2↑ ■判断复分解反应发生的条件: a.有沉淀生成; b.有气体放出; c.有水生成; d.如果是没有酸参加的反应,则两种反应物必须都溶于水。 二、几种常见的盐 1.氯化钠(NaCl) 厨房中常见的调味剂;生理盐水的成分;农业上用来选种;做冰雪消融剂。 2.碳酸钠(Na2CO3) (1)俗名:纯碱、苏打 (2)纯碱不是碱,是盐(水溶液显碱性) (3)用途:玻璃、造纸、纺织和洗涤剂的生产等 (4)Na2CO3+ 2HCl =2NaCl + CO2↑+ H2O(灭火器的原理) 3.碳酸氢钠(NaHCO3) (1)俗名:小苏打 (2)用途:焙制糕点;发酵粉的主要成分、治疗胃酸过多; (3)NaHCO3+ HCl =NaCl + CO2↑+ H2O . 4.碳酸钙(CaCO3) (1)大理石、石灰石、钟乳石、贝壳、珍珠、蛋壳、锅炉和水壶的水垢的主要成分 (2)用途:建筑材料、补钙剂 (3)CaCO3+2HCl===CaCl2+ CO2↑+ H2O; (4)相对分子质量为100,Ca元素的质量分数占40%. 补充:碳酸盐(CO32-、HCO3-)的检验: A.向待测溶液中加入稀HCl后有气泡生成,将产生的气体通入澄清石灰水,若澄清石灰 水变浑浊,则溶液中含有CO32-;若澄清石灰水无变化,则溶液中不含有CO32-。 B.向待测溶液中加入BaCl2溶液后有白色沉淀生成,滴入稀HCl后,沉淀消失且有气泡生 成,则溶液中含有CO32-。 三、化学肥料 农作物的生长需要N、P、K等营养元素。含有这些元素的某些物质可以作为肥料。通过化学加工生产的肥料,称作化学肥料。 1、常用的肥料: 化学肥料:氨气(NH3·H2O)、碳酸氢铵(NH4HCO3)、硫酸钾(K2SO4)、磷矿粉[主要成分磷酸钙Ca3(PO4)2]、硫酸铵[(NH4)2SO4]、尿素[CO(NH2)2]、硝酸钾(KNO3)、磷酸二氢铵(NH4H2PO4)。 农家肥料:如厩肥、人粪尿、绿肥等。 2、各种肥料的功效(钾抗倒伏磷抗旱(寒),叶片发黄要用氮) 氮肥作用:促进植物茎、叶生长茂盛、叶色浓绿(促苗); 缺氮:叶黄 钾肥作用:促使作物生长健壮、茎杆粗硬,抗倒伏(壮秆); 缺钾:叶尖发黄,易倒伏 磷肥作用:促进植物根系发达,穗粒增多,饱满(催果); 缺磷:生长迟缓,产量降低,根系不发达。 3、氮、磷、钾三种化肥的区别方法
|
- 上一篇:2023年初中化学有关酸碱盐的化学方程式
- 下一篇:2023年初三化学酸碱盐知识点