【金属活动性顺序定义】
指的是金属的活跃性,代表了金属的反应活性。
【金属活动性顺序表】
由常见的金属在溶液中的活动性大小进行排序得到的表。这张表的表示如下:
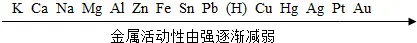
说明:
(1)元素周期表内除稀有气体(旧称惰性气体)外元素的金属性越是在左下方越强,越是在右上方越弱。
(2)金属的活动性与反应的剧烈程度无关。
(3)金属的金属性从左到右递减,左边的金属可以将右边的金属从其盐溶液中置换出来。
(4)氢前边的金属可以和酸发生反应置换出氢气,氢之后的金属则不能。
(5)钾、钙、钠这三种金属比较活波,可以直接和水发生反应,生成氢气。
【金属活动性顺序的应用】
1.判断金属活动性的强弱
2.判断金属和酸是否可以发生置换反应
反应条件:
①排在氢前面的金属才能置换酸中的氢,金属越活泼,反应越剧烈。
②酸一般指盐酸和稀硫酸。
③Fe跟酸反应生成的是亚铁盐。
3.判断金属与盐溶液是否发生置换反应
反应条件:
①反应物中单质金属要排在盐中金属元素前面。
②反应物中盐必须是可溶性的,即是盐溶液。
③K、Ca、Na等活动性极强的金属由于常温下就能与盐溶液中的水发生反应,生成碱,故不能置换出盐中的金属。
④Fe跟盐溶液反应生成的是亚铁盐。
金属活动性顺序以及学习中的实际应用是初中化学学习化学反应的一个首要前提,希望同学们一定要掌握。
(责任编辑:admin)
|