|
2010—2011学年度第一学期初中化学期末试题 四川省双流县棠湖中学 桂航程(供稿) 可能用到的相对原子质量: K-39 I-127 O-16 C-12 H-1 Cl-35.5 第Ⅰ卷 选择题(共36分) 一、选择题(每题只有一个符合题意的答案,将所选答案的序号用2B铅笔涂在答题卷相应的位置) 1.“长征2号F”型运载火箭在升空时发生的下列变化属于化学变化的是( ) A. 火箭点火 B.导流槽内的水受热汽化 C. 隔热材料脱落 D. 整流罩脱落 2.“神州七号”太空舱利用NiFe2O4将航天员呼出的废气转化为航天员需要的气体,而NiFe2O4的质量和化学性质都不变化,在该过程中NiFe2O4是( ) A.反应物 B.生成物 C.催化剂 D.消毒剂 3.下列有关水的知识中,错误的是( ) A.用过滤的方法可使浑浊的河水净化为纯净水 B.硬水中含较多的可溶性钙、镁化合物,软水中则不含或少含 C.用煮沸或蒸馏的方法能降低水的硬度 D.用加肥皂水的方法可鉴别硬水和软水 4.饮用水用氯气(Cl2)消毒会促使一些致癌物质生成。为消除隐患,现已采用高效安全的二氧化氯(ClO2)消毒杀菌。下列对ClO2的叙述中错误的是( ) A. ClO2不是氧化物 B. ClO2是由氯元素和氧元素组成 C. ClO2中没有氧分子 D. ClO2氯、氧两种元素的质量比为1︰2 5.下图所示方框中,符合2H2表示意义的示意图是( )  6. 下列化学用语中,正确的是( ) A.硫酸钠的化学式NaSO4 B.四个氮原子2N2 C.三个碳酸根离子3CO32- D.硫在氧气中燃烧2S+3O2  2SO3 2SO37.对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )  ①图Ⅰ烧杯中的水:形成密闭系统,观察检查时的现象 ②图Ⅱ量筒中的水:通过水的体积变化得出O2的体积 ③图Ⅲ集气瓶中的水:吸收放出的热量 ④图Ⅳ集气瓶中的水:冷却溅落熔化物,防止集气瓶炸裂 A.①②③④ B.①②③ C.①②④ D.③ 8. 潜水艇里需要配备氧气的发生装置,以保证长时间潜航,下列反应都能产生氧气,其中最适宜在潜水艇里供给氧气的反应是( ) A. 氧化汞  汞 + 氧气 B. 水 汞 + 氧气 B. 水 氢气 + 氧气 氢气 + 氧气C.过氧化钠 +二氧化碳=碳酸钠+氧气 D.过氧化氢  水 + 氧气 水 + 氧气9.下列对化学反应前后质量变化的解释,不符合质量守恒定律的是(???) A.高锰酸钾受热分解后固体剩余物的质量减小,是因为放出了氧气 B.蜡烛燃烧后质量变小,是因为蜡烛受热形成了石蜡蒸气 C.细铁丝在氧气中燃烧后,质量增大,是因为生成物中含有氧的质量 D.白磷在密闭容器中燃烧,反应前后总质量不变,是因为生成物没有逸散 10.有关下图所示的五种物质的说法正确的是( ) 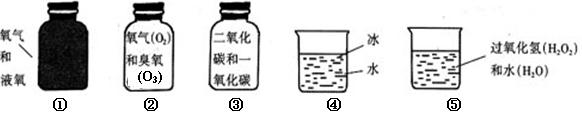 A.五种物质都是混合物 B.①③有相似之处,都盛放了不同状态的同种物质 C.③属于单质,④属于化合物 D.②和⑤盛放的两种物质有相似之处:元素种类相同,但分子构成不同 11. 在一密闭容器中,盛放A、B、C三种物质各30g,经电火花引燃,充分反应后,各物质质量变化如下:
关于此反应,下列认识不正确的是( ) A.C物质中所含有的元素种类是A、B、D三种物质中所有元素种类之和 B.变化后待测的A质量为5g C.该变化的基本反应类型是分解反应 D.A物质有可能是单质 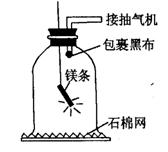 12.某研究性学习小组为验证质量守恒定律,设计了下图所示的装置(放在石棉网上的仪器是玻璃钟罩)进行实验。下列说法不正确的是 ( ) 12.某研究性学习小组为验证质量守恒定律,设计了下图所示的装置(放在石棉网上的仪器是玻璃钟罩)进行实验。下列说法不正确的是 ( ) A.玻璃钟罩的作用是既便于收集镁条燃烧产生的白烟,又避免白烟污染空气 B.实验后,将玻璃钟罩内所有的白色固体合在一起称量,其质量小于燃烧前镁条的质量 C.装置中玻璃导管接抽气机的目的是防止白烟从钟罩与石棉网的缝隙中逸出 D.装置中导管口“包裹黑布”的作用是防止白烟从导管中逸出 第Ⅱ卷 非选择题(共64分,请把答案填在答题卡上) 二、完成下列各题 13.(7分)在食盐中加入碘酸钾( KIO3 )有益于防治地方性甲状腺肿大下表是某市场销售的一种“加碘食盐”包装袋上的部分说明。
(1)上述“含碘量”中的碘是指 (填代号) A. 碘酸钾 B. 碘元素 C. 碘单质 D. 碘分子 (2)碘酸钾( KIO3 )中碘的化合价为 。 (3)由上述文字说明可推测碘酸钾的化学性质是(答一条即可) 。 (4)碘酸钾中碘的质量分数为 ,上述“加碘食盐”1000g中含碘酸钾的最低质量为 mg(保留一位小数)。 (5)用固体单质碘(I2)与氯酸钾在一定条件下发生反应,可制得固体碘酸钾(KIO3),同时生成气体氯单质(Cl2)。该反应的化学方程式为 。 14.(10分)化学用语是学习化学的重要工具。 (1)用化学符号表示:2个一氧化二氯分子 ,氯化亚铁 。 (2)已知镍元素Ni显示+2价,磷酸根PO4显示–3价,写出下列物质或粒子的化学符号: 磷酸镍 ,3个磷酸根离子 。 (3)小强同学在化学晚会上进行化学用语接龙活动,我也来参与。 例如:
我的实践:(下表中的答案不能与上表中的任何答案雷同)
(4)达菲是治疗甲型H1N1流感的一种药物,化学式为C16H31N2PO8。从达菲的化学式获得的信息有(写一条即可) 。 15.(6分)化学方程式的书写是学习化学的根本。 (1)加热高氯酸铵(NH4ClO4)会分解生成四种物质。一种是氯气(Cl2);还有一种是生活中最常见的液体,人们每天都饮用它;另外两种是空气中的主要成分,该变化的化学方程式为: 。   ①写出该反应的化学方程式: 。 ②上述参加反应的两种物质均是无色气体,若将这两瓶气体充分混合,推测出现的现象是:有 产生,同时还有水珠产生。 ③该反应中,硫元素化合价的变化情况是 。 16.(7分)著名的科学家诺贝尔经过长期的试验,研制出安全炸药。炸药三硝酸甘油酯(C3H5N3O9)发生爆炸的化学方程式为:4C3H5N3O9 (1)推断X的化学式为__ _,做出这种推测的依据是 。 (2)若生成13.2 g二氧化碳,则同时生成氧气的质量是多少?(写出具体步骤) 17.(7分)下表是元素周期表中的一部分:
(1)地壳中含量仅次于氧的元素(填符号)是 。 (2)分析上表规律可推知,表中X= 。 (3)上表元素中,由氯元素与一种金属元素组成的化合物共有 种。 (4)元素M的某化合物的化学式为MOH,它的相对分子质量为23.941,则M元素的符号是 。 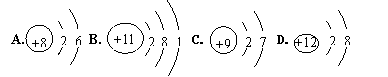 (5)A、B、C、D四种粒子的结构示意图如右图: (5)A、B、C、D四种粒子的结构示意图如右图: 属于阳离子的是 (选填序号),它的化学符号是 。 (6)查阅资料可知:金属的活动性取决于该金属原子的电子层数和最外层电子数,电子层数越多,最外层电子数越少,该金属的活动性越强。铷元素(元素符号为Rb)的原子结构示意图为:  铷的金属活动比钠 (填强或弱)。 18.(共12分)我们常用实验探究的方法来研究常见物质的组成,如下图:  (1)实验A是利用可燃物消耗瓶内的 ,使瓶内压强减少来推测空气里氧气的含量;其反应方程式为 。 (2)实验B是通过证明生成物的 推断水的组成的。其反应方程式为 。 (3)蔗糖是我们经常接触的一种食品,生活中,我们偶尔会看见蔗糖在锅里,加热时间过长会变成黑色。 提出问题:蔗糖是由哪些元素组成的呢? 查阅资料可知: Ⅰ.铜丝在加热条件下能与氧气发生反应生成黑色固体氧化铜。 Ⅱ. 蔗糖在空气中燃烧生成二氧化碳和水。 实验步骤:某同学用C装置进行实验(夹持和支撑装置略去)来测定蔗糖的组成。先用酒精灯在玻璃管铜丝处加热,使之充分反应后,同时不断反复拖拉注射器活塞,再将酒精灯移至蔗糖处进行加热。观察到玻璃管中蔗糖处留下黑色的固体,内壁有水珠。 ①实验结论:蔗糖中一定含有 元素。 ②实验原理:与 (填A或B)实验相同。 ③反思:上述实验过程中,先对铜丝进行加热,目的是 ,实验时反复推拉注射器活塞的作用是 。 ④拓展:Cu在空气中长时间露置会与氧气和空气中另两种常见物质发生反应而生成铜锈【化学式为Cu2(OH)2CO3】。生成铜锈时参加反应的空气中的另两种物质是 和 。 19.(15分)通过对化学的学习,你已经掌握了实验室制取气体的有关规律,请结合下图回答问题: 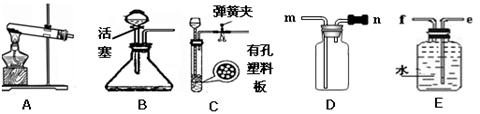 (1)用装置A制氧气。 ①用装置A制氧气的化学方程式为 。 ②冬冬用AD相连制取和收集的氧气,来做铁丝在氧气中燃烧的实验,结果没有观察到剧烈燃烧,火星四射的现象。你认为下列不属于该实验失败的主要原因是 。 A.氧气不纯 B.集气瓶没预先装少量水 C.铁丝太粗 D.系在铁丝上的木柴燃烧尽了,才将铁丝伸入集气瓶 (2)同学们用二氧化锰催化过氧化氢溶液的方法制氧气时,探究了影响化学反应速率的部分因素,实验数据如下表:
①二氧化锰催化过氧化氢溶液的方法制氧气的化学方程式为 。 ②通过实验Ⅰ和Ⅱ对比可知,化学反应速率与 有关; 从实验Ⅲ和Ⅳ对比可知,化学反应速率与温度的关系是 ; ③化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是 。 ④用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量是减小、不变还是增大呢? 。 ⑤学习了双氧水制氧气的实验后,王林同学想起自己家里有一瓶消毒用的双氧水,经查看发现已过期,他用实验证明了这瓶双氧水已经完全变质。请你猜想王林同学的实验步骤是: ,对应的实验现象是 。 (3)实验室常用硫化亚铁的块状固体与稀盐酸(液体)在常温下反应制硫化氢气体。硫化氢气体是无色有刺激性气味的有毒气体,它的密度比空气大,易溶于水。 ①制取硫化氢时选用的发生装置 或 。  ②硫化氢气体排放到空气中会污染空气。硫化氢气体可被水吸收,用碱液(如NaOH溶液)吸收效果最好。收集硫化氢气体时, 应将 端(选填m、n、e、f)与右图的 端(填g、h)相连。 ②硫化氢气体排放到空气中会污染空气。硫化氢气体可被水吸收,用碱液(如NaOH溶液)吸收效果最好。收集硫化氢气体时, 应将 端(选填m、n、e、f)与右图的 端(填g、h)相连。参考答案 1A、2C、3A、4D、5A、6 C、7D、8C、9B、10 D、11B、12B 13.(共7分,方程式2分,其余每空1分) (1)B (2)+5 (3)见光、受热易分解,容易与空气中的某些成分反应而变质 (4)59.3% 33.7 (5)I2+ 2KClO3=2 KIO3+Cl2↑ 14.(共10分,每空1分)(1)2Cl2O FeCl2 (2)Ni3( PO4)2 3PO42- (3)①O ②O2 ③CO3 ④CaCO3 ⑤ (其他合理答案也可)。 ( 4 ) 达菲由碳、氢、氮、磷、氧五种元素组成 或 一个达菲分子由16个碳原子、31个氢原子、2个氮原子、1个磷原子、8个氧原子构成或其他合理答案。 15.(共6分,每个方程式2分,其余每空1分) (1)2NH4ClO4 (2)① 2H2S + SO2=== 3S + 2H2O ②黄色固体 ③由-2、+4价变为0价 16.(共7分,第1小题每空1分,第2小题共5分) (1)N2 质量守恒定律或化学反应前后各原子的种类、数目不变 (2)[解]设生成O2的质量为x。 4C3H5N3O9 12×44 32 13.2 g x x = 0.8 g 答:生成O2的质量为0.8 g。 17.(共7分,每空1分)(1)Si (2)16 (3)5 (4)Li (5)D Mg2+ (6) 强 18.(共12分,每个方程式2分,其余每空1分)(1)氧气 4 P+5O2  2P2O5 2P2O5 (2)元素种类或氢气、氧气 2H2O  2H2↑+O2↑ 2H2↑+O2↑ (3)①碳、氢、氧三种 ②B ③耗尽密闭容器内空气中的氧气,以免对蔗糖组成的测定产生干扰 增大铜丝与空气的接触面积或让密闭容器内空气中的氧气充分与铜丝反应 ④H2O CO2 19.(15分,每个方程式2分,其余每空1分) (1)①2KMnO4 (2)① 2H2O2 ②反应物浓度(或浓度) 温度越高,化学反应速率越快 ③反应物浓度越大,单位体积的反应物中含有的粒子数越多,粒子间碰撞的机会越大,化学反应速率越快 ④不变 ⑤取样于试管中,加入二氧化锰,再伸入带火星的木条 无气泡冒出,且木条不复燃 (3)①B C ② n g (责任编辑:admin) |

