|
☆☆☆ 点击下载试题 ☆☆☆ 第Ⅰ卷(选择题共60分) 本卷共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是最符合题目要求的。 1.Na2CO3和NaHCO3是金属钠常见的两种碳酸盐,它们广泛地应用于生产和生活中。下列有关碳酸钠和碳酸氢钠的说法中,不正确的是() A.NaHCO3能中和胃酸,对胃壁不产生强烈的刺激或腐蚀作用,可用于治疗胃酸过多症,但不适合胃溃疡病人 B.NaHCO3能中和面粉发酵后产生的酸,并且产生二氧化碳气体,可用于做馒头 C.Na2CO3溶液中混有NaHCO3时,用给溶液加热的方法不能除去 D.往Na2CO3饱和溶液中通入CO2气体,可获得NaHCO3沉淀,由此可说明Na2CO3的溶解度比NaHCO3大 2.设NA为阿伏加德罗常数的数值,下列各项叙述中正确的有()。 ①0.2molH2O2完全分解转移的电子数为0.4NA ②25℃、101kPa下,16gO3和O2混合气体中含有的氧原子数为NA ③将含0.1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为0.1NA ④1molFe溶于过量稀硝酸,电子转移数为3NA ⑤标准状况下,22.4LCHCl3中含有的氯原子的数目为3NA A.①②③B.①②④⑤C.①②③④D.②④ 3.下列有关NA的叙述正确的是() A.某无水乙醇与足量金属钠反应生成5.6LH2(标况),则该乙醇分子中共价键总数为4NA B.标况下,22.4L甲烷与22.4L氯气在光照下充分反应,生成的CH3Cl分子数一定为NA C.在密闭容器中加入1.5molH2和0.5molN2,充分反应后得到NH3分子数为NA D.常温常压,56g铁片投入足量浓硫酸中生成SO2分子数为NA 4.下列叙述或实验现象描述正确的是() A.将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸具有酸性 B.往足量铁与稀硝酸反应后的溶液中滴入KSCN溶液,溶液变为血红色 C.往FeSO4溶液中通入NO2气体,溶液始终无明显现象 D.往BaCl2溶液中通入SO2气体,无沉淀产生,再通NH3,产生白色沉淀 5.下列说法正确的是() A.往某溶液中加入稀NaOH溶液,无刺激性气味的气体产生,说明该溶液一定不含NH4+ B.用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl会升华 C.SO2气体和Cl2均能使品红溶液褪色,说明两者均有强氧化性 D.浓硫酸可用来干燥H2、Cl2、SO2等气体,说明浓硫酸具有吸水性 6.下列实验装置或操作不符合实验要求的是() 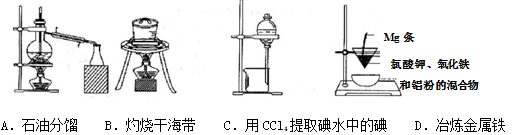 7.已知2Fe3++2I﹣═2Fe2++I2、Br2+2Fe2+═2Br﹣+2Fe3+。现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是 ①按I﹣、Fe2+、Br﹣的顺序还原性逐渐减弱; ②原溶液中Br﹣一定被氧化; ③通入氯气后原溶液中Fe2+一定被氧化; ④不能确定通入氯气后的溶液中是否还存在Fe2+; ⑤若取少量所得溶液,加入CCl4充分振荡后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br﹣均被完全氧化. A.①②③④B.①③④⑤C.②④⑤D.①②③④⑤ 8.保护环境已成为人类的共识,下列做法不利于环境保护的是 A.火力发电厂的煤经粉碎、脱硫处理 B.电镀废液经中和后直接排入到农田 C.聚乳酸塑料代替传统塑料作购物袋 D.回收并合理处理聚氯乙烯塑料废物 9.有关营养物质的说法正确的是 A.在淀粉与稀硫酸共热后的溶液中,滴加银氨溶液,检验水解产物中的葡萄糖 B.纤维素在人体内可水解生成葡萄糖,进而被氧化为二氧化碳和水,释放能量 C.油脂的水解在碱性条件下可生产肥皂,在酸性条件下生成甘油和高级脂肪酸 D.蛋白质水解的最终产物是氨基酸;遇重金属盐则发生盐析,稀释后仍能溶解 10.下列关于金属冶炼的叙述正确的是 A.工业上可利用铝热反应大量冶炼金属铁 B.金属钠、铝和铜都可用热还原法制备 C.CO还原磁铁矿得到9mol铁时转移24mol电子 D.电解饱和氯化镁溶液可得金属镁 11.2015年11月29日至30日,国家主席习近平出席了气候变化巴黎大会,各国就如何应对气候变化、提升经济绿色水平,实现人类可持续发展进行商讨。为达成“同呼吸,共奋斗”全国各地为治理雾霾广泛开展了一系列活动。下列活动不符合这一主题的是() A.机动车实行限行措施是减少雾霾的途径之一 B.积极推广风能、太阳能、氢能等新型能源的使用 C.将秸秆焚烧可得富含钾肥的草木灰,焚烧是一种较为理想的秸秆处理办法 D.通过吸收空气中CO2并利用廉价能源合成汽油可推广“绿色自由”计划 12.下列文字表述与反应方程式对应且正确的是() 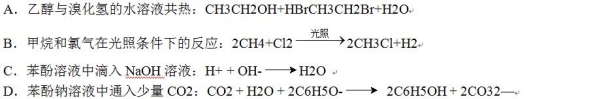 13.化学与生活密切相关。下列说法正确的是() A.福尔马林可作食品的保鲜剂 B.乙烯可作水果的催熟剂 C.做衣服的棉和麻均与淀粉互为同分异构体 D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 14.自然环境与人们的生活息息相关。下列有关环境问题的说法不正确的是() A.氟利昂(CCl2F2)因破坏大气臭氧层而导致“温室效应” B.将垃圾分类并回收利用是垃圾处理的发展方向 C.废旧电池的回收,其主要目的是保护环境,而不是回收金属 D.淀粉餐具被认为是有发展前景的一次性餐具,可有利于保护环境 15.化学与环境、材料、信息、能源关系密切,下列说法正确的是() A.绿色化学的核心是应用化学原理对环境污染进行治理 B.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题 C.PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 D.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 16.化学与人类生产、生活密切相关,下列说法正确的是 A.蚕丝和棉花的组成元素相同,结构不同,因而性质不同 B.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 C.古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品 D.工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 第Ⅱ卷非选择题(共6小题,52分) 17.M是一种新型可生物降解的高分子材料,主要制造可降解纤维、塑料和医用材料,其水解最 终产物为N。燃烧9.0g的N只产生CO2和H2O,且质量分别为13.2g和5.4g,实验测得N在标准状况下的蒸气密度为4.02g/L;N的核磁共振氢谱显示的峰面积之比为1:1:1:3。 (1)通过计算确定N的分子式 (2)写出N的结构简式,并写出N在催化剂条件下缩聚反应合成M的化学方程式. 18.国家规定,酿造食醋的总酸含量标准为3.5~5.0g/100mL(总酸含量即100mL食醋中CH3COOH的质量).某化学兴趣小组为测定某市售食醋的总酸含量,进行了实验.实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应.计算该市售食醋样品中的总酸含量,并说明是否符合国家标准.(假设该市售食醋样品中其他物质不与氢氧化钠发生反应) 19.叶绿素在光的作用下可将CO2和H2O转化为葡萄糖(C6H12O6)和O2, 叶绿素有a、b两种,已知某种叶绿素中仅含有C、H、O、N、Mg五种元素,且知该叶绿素中各元素的质量分数分别是: w(C)=73.99%w(H)=8.072%w(O)=8.969%w(N)=6.278%w(Mg)=2.691% 经测定该叶绿素的相对分子质量小于1000,试确定该叶绿素的分子式。 20.近期,我国个别企业违法排污导致地下 水严重污染又成为媒体焦点。对水的质量监控 有很多指标,其中水中溶解氧(DO)的多少是衡量水体自净能力的一个指标。 I.对溶解氧(DO)的测定步骤是: ①在一定温度下量取100.00mL新鲜水样,在碱性条件下使其中的O2将Mn2+氧化为MnO(OH)2: ②向步骤①反应后的溶液中加入KI溶液,使其中生成的MnO(OH)2再还原成Mn2+: ③最后用0.0100mol·L-1Na2S2O3标准溶液滴定步骤②中生成的I2: 消耗Na2S2O3标准溶液11.00mL。 (1)步骤③使用的指示剂是淀粉试液。滴定终点时指示剂的颜色变化情况是____。 (2)硫代硫酸(H2S2O3)是一种二元弱酸。步骤③应选用____滴定管进行滴定,结合离子方程式说明原因:______。 (3)水样中溶解氧(DO)的浓度为mg·L-1。 II.该实验需用Na2S2O3固体配制100mL0.0100mol·L-1Na2S2O3标准溶液。 (4)请按配制的过程填写选用仪器的顺序:____(填编号)。 ①玻璃棒②胶头滴管③100mL容量瓶④天平⑤25mL烧杯 (5)配制0.0100mol·L-1Na2S2O3标准溶液时,下列操作使所配溶液浓度偏高的是____。 A.没有用蒸馏水洗涤烧杯 B.定容时俯视容量瓶刻度线 C.配制前容量瓶洗净后没干燥 D.摇匀后见液面下降,再加水至刻度线 E.用天平称量药品时,左盘低,右盘高 21.(6分)下表是某“加碘食盐”包装袋上的部分文字说明。
经测定,该“加碘食盐”中KIO3的含量为42.8mg·kg-1。计箅每千克“加碘食盐”中KIO3的物质的量为 mol,该“加碘食盐”的含碘量为 mg·kg-1。 (2)将5.0g该“加碘食盐”溶于水中配成100mL溶液,该溶液中IO离子物质的量浓度为mol·L-1。 22.(12分)为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下 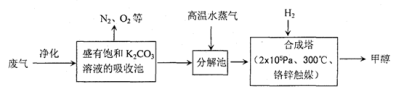 (1)合成塔中反应的化学方程式为;△H<0。从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了。 (2)从合成塔分离出甲醇的原理与下列操作的原理比较相符(填字母) A.过滤B.分液 C.蒸馏D.结晶 工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括. (3)在体积为2L的合成塔中,充人2molCO2和6molH2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。 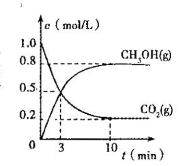 从反应开始到平衡,V(H2)=_____;能使平衡体系中nCH3OH)/n(CO2)增大的措施有_____。 (4)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。 巳知 写出C02(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式____。 (责任编辑:admin) |
