|
☆☆☆ 点击下载试题 ☆☆☆ 此试题可能存在乱码情况,在查看时请点击右上角全屏查看 2018年开封中考化学计算题专项训练 1.侯氏制碱法的核心反应原理如下: NH3 + CO2 + NaCl + H2O == NH4Cl + NaHCO3 某温度下,向溶质的质量分数为20%的氯化钠溶液47.25 g中通入一定量氨气(NH3) 和二氧化碳。充分反应后,将溶液中析出的碳酸氢钠晶体过滤,低温烘干,称量,质 量为4.4 g。计算需要通入氨气的质量。 (已知:该温度下碳酸氢钠饱和溶液中,碳酸氢钠与水的质量比为1:9;且溶液中若存在其它溶质,不会对上述比值产 2.据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜。 2Cu + 2H2SO4 + O2 2CuSO4 + (2)某同学想利用此反应,将80 g含铜80%的废料转化为10%的硫酸铜溶液,计算需要加入10%的稀硫酸和水的质量(假设杂质不参加反应,也不溶于水)。 3.合成氨工业生产中所用催化剂的主要成分是FeO和Fe2O3,且FeO与Fe2O3的质量比为9∶20时,其催化活性最大。以Fe2O3为原料制备该催化剂时,可加入适量木炭粉,发生如下反应: 2Fe2O3+C ![E:\06—修图软件\新建文件夹\19 [转换].jpg](/uploads/collect/201905/11/164647.0043205.png) 4.实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀的质量关系如右图所示。 4.实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀的质量关系如右图所示。(1)实验中生成沉淀的最大质量是 g。 (2)开始加入碳酸钠溶液时,还没有产生沉淀 的原因是 。 (3)计算原滤液中氯化钙的质量分数。 (已知:CaCl2+Na2CO3=CaCO3↓+2NaCl) 5.某化工厂生产的纯碱产品(含有少量氯化钠)的包装袋上注明:碳酸钠≥96%。 为了测定该产品中碳酸钠的质量分数是否属实,向4个分别盛有浓度相同、质量均为100 g稀盐酸的烧杯中,分别放入不同质量的纯碱产品,充分反应后,称量烧杯中剩余物的质量,实验数据如下表:
请计算(最后结果保留一位小数): (1)该纯碱产品中碳酸钠质量分数的标注 (2)所用盐酸溶液中溶质的质量分数。 (3)恰好完全反应时,所得溶液中溶质的质量分数。 6.过氧化氢的水溶液俗称双氧水,在放置过程中会缓慢分解。现有一瓶未曾使用过的、久置的双氧水,瓶上商品标签提供了如下信息: ①H2O2的质量分数为30%; ②内装溶液质量1 000 g。 经实验测定,其中H2O2的质量分数现仅为10%。 请计算: 新-课 -标-第-一- 网 (1)若用这瓶双氧水来配制3%的医用双氧水1500 g,需用这种双氧水的质量是多少? (2)计算这瓶双氧水中已分解的过氧化氢的质量。  7.过氧化氢溶液在存放过程中会自然分解,使溶质质量分数减小。某同学使用一瓶原标注为30%的过氧化氢溶液完成制取氧气的实验。通过称量,该瓶中共有116.8 g溶液,取出13.6 g在一定条件下进行实验,发现生成气体的质量与反应时间的关系如右图所示。试计算 7.过氧化氢溶液在存放过程中会自然分解,使溶质质量分数减小。某同学使用一瓶原标注为30%的过氧化氢溶液完成制取氧气的实验。通过称量,该瓶中共有116.8 g溶液,取出13.6 g在一定条件下进行实验,发现生成气体的质量与反应时间的关系如右图所示。试计算⑴现在这瓶过氧化氢溶液的溶质质量分数。 ⑵该瓶溶液中,已经分解的过氧化氢质量。 8.盐水选种是我国古代劳动人民发明的一种巧妙的挑选种子的方法。农业生产上常用溶质质量分数为15%-20%的氯化钠溶液来选种。 (1)要配置150kg16%的氯化钠溶液,计算应称取氯化钠的质量。 (2)选种进行一段时间后,农技员估计溶液和溶质质量分数都有所减少,他取出50g氯化钠溶液,加入过量AgNO3溶液,得到沉淀14.35g,计算氯化钠溶液中溶质的质量分数。 (反应原理为:AgNO3+ NaCl = AgCl↓+NaNO3) (3)若此时氯化钠溶液的质量只剩下100kg,要使溶液质量和溶质质量分数都恢复到(1)中的状态,计算需要加入的氯化钠和水的质量。 9.盐碱湖中捞出来的纯碱中含有一定量的食盐,为测定其中碳酸钠的含量,化学小组的同学将某纯碱样品24.6g放入烧杯中,逐滴加入150g稀盐酸,恰好完全反应,待不再产生气泡时,得到168g的食盐溶液。计算原混合物中碳酸钠的质量分数和反应后溶液的溶质质量分数(CO2的溶解忽略不计)。 2Cu + 2H2SO4 + O2 2CuSO4 +2H2O。若用一定量溶质的质量分数为9.8%的稀硫酸恰好处理2000g含铜3.2%的废料(假设其他杂质不和硫酸反应且不溶于水),求反应后所得硫酸铜溶液中溶质的质量分数。 11.由醋酸溶液和醋酸钠溶液混合而成的缓冲溶液(其中醋酸的质量分数为2.5%)在农业上常用于土壤分析、农用微生物的培育等。某同学用5%的醋酸溶液和400 g10%的氢氧化钠溶液混合配制该缓冲溶液,所需醋酸溶液的质量为多少克?(资料:反应的化学方程式为:NaOH + CH3COOH = CH3COONa + H2O) 12.现有Cu与另一种金属(可能是Mg、Fe、Zn中的一种)形成的粉末。现欲测定其组成,进行如下实验:取该粉末16g放入烧杯,将溶质质量分数为14%的稀硫酸280.0g分4次加入该烧杯中,充分反应后,测得剩余的固体质量数据记录如下:
计算(要求写出计算过程): (1)该粉末中Cu的质量分数。 (2)该粉末中另一种金属为何种金属。 (3)第3次加入稀硫酸充分反应后,所得溶液中溶质的质量分数。 2018年开封中考化学计算题专项训练参考答案 1.(3分)1.7 g 给分点参考如下: (1)利用1:9建立溶质与溶剂质量关系 1分 (2)能找出反应中NH3、H2O、NaHCO3质量关系 1分 (3)求出氨气的质量为1.7 g 1分 【解】设:需要氨气的质量为 NH3 + CO2 + NaCl + H2O ==== NH4Cl + NaHCO3 17 18 84 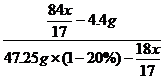 = = (1)2H2O (2)解:设生成硫酸铜的质量为x,生成水的质量y,消耗H2SO4的质量为z。 2Cu + 2H2SO4 + O2 = 2CuSO4 + 2H2O 128 196 320 36 80g×80% z x y 硫酸铜溶液的质量= = 1600 g 加入水的质量= 1600 g―160 g―18 g―980 g×90% = 540 g ………… (1分) 答:略。 3.解:设生成FeO的质量为x;需加入木炭粉的质量是y。 2Fe2O3 + C 320 12 288 y x 反应后剩余Fe2O3的质量为: 参加反应Fe2O3的质量为:160 g- 则列式: 解得:x=48g ……………………1分 列式: 解得:y=2 g 答:需加入木炭粉2 g 4.(1)5 ·········································1分 (2)稀盐酸先与碳酸钠反应 ·································1分 (3)解:设原滤液中CaCl2的质量为x Na2CO3+CaCl2 = CaCO3↓+ 2NaCl 111 100 x= 原滤液中CaCl2的质量分数= ·················1分 答:原滤液中氯化钙的质量分数是11.1%。 5.【解】盐酸完全反应时,生成二氧化碳的质量为100 g﹢11.2 g﹣106.8 g﹦4.4 g。 设:纯碱产品中碳酸钠质量为x,稀盐酸中溶质的质量为y,生成氯化钠的质量为z。 Na2CO3 + 2HCl 2NaCl + H2O + CO2↑ 106 73 117 44 x y z 4.4 g x = 10.6 g y = 7.3 g z = 11.7 g (1)纯碱产品中碳酸钠的质量分数 (2)盐酸溶液中溶质质量分数 (3)氯化钠溶液中溶质质量分数 6.设所需这种双氧水的质量为x, 则x×10%=1 500 g×3%, X=450g --------1分 (2) 设这瓶双氧水变质过程中减少的过氧化氢的质量为y 2H2O2MnO22H2O+O2↑ 68 32 y 32/68Y 余下溶质H2O2的质量为300g-y,余下溶液的质量为1000g-32/68Y。 再根据变质后溶液中溶质的质量分数为10%列出长等式:  ----------------1分 ----------------1分求出y=209.9----------------1分 2H2O2 2H2O + O2↑ 68 32 x 1.6 g 该溶液中溶质的质量分数= 2H2O2 2H2O + O2↑ 68 32 y z [y+116.8g×25%]/(116.8+ y+29.2=35.04+9.6/68 y y=6.8g 答略 8.解:(1)150kg×16%=24 kg --------------(1) (2) 设生成氯化钠的质量为X AgNO3+ NaCl = AgCl↓+NaNO3 58.5 143.5 X 14.35g 58.5 :143.5 = X :14.35 g X =5.85 g (5.85/50)×100%=11.7%------------(1) 需要加入氯化钠的质量为:24 kg﹣100 kg×11.7%=12.3 kg 需要加入水的质量为:150 kg﹣100 kg﹣12.3 kg=37.7 kg 9.设: 原混合物中碳酸钠的质量为X ,生成氯化钠的质量为Y,生成二氧化碳的质量为z。 Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 106 117 44 X Y 6.6g X=15.9g Y=17.6g 10.2000g×3.2%=64 g 设需硫酸的质量为x,参加反应氧气的质量为y, 生成硫酸铜的质量为z 2Cu + 2H2SO4 + O2 2CuSO4 +2H2O 128 196 32 320 64 g x y z 98 g÷9.8%=1000g 答:反应后所得硫酸铜溶液中溶质的质量分数为14.8%。 11.解:设:40 NaOH + CH3COOH=CH3COONa + H2O 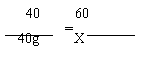 = 40g = 40gX = 60g 设:反应后溶液中醋酸的质量为Y 12.(1)该粉末中Cu的质量分数为 (2)[解]设:另一种金属为M,其相对分子质量为x 分析表格中数据可知每70g稀硫酸与2.4g金属M恰好完全反应 2.4g x = 24 该金属为镁 ……………………………………………… (1分) (3)[解]第3次加入稀硫酸充分反应后,消耗金属镁的质量为7.2g。 设:此时生成MgSO4 的质量为y,生成 H2的质量为z M g + H2SO4 === MgSO4 + H2↑ 24 7.2g y z 则此时所得溶液中溶质质量分数为 答:略 (责任编辑:admin) |
