|
☆☆☆ 点击下载试题 ☆☆☆ 2018年河南中考化学试卷真题【word版含答案】 (满分:50分 考试时间:50分钟) 相对原子质量 H:1 C:12 O:16 N:14 Mg:24 Al:27 S:32 Cl:35.5 Ca:40 Cu:64 Zn:65 一、选择题(本题包括14个小题,每小题1分,共14分,每题只有一个选项符合题意) 1. 生活中的下列变化,属于物理变化的是 【 】 A.蜡熔化 B.铁生锈 C.米酿酒 D.纸燃烧 2.开封小笼包是地方特色美食,其主要食材瘦内中富含的营养素为 【 】 A.糖类 B.油脂 C.维生素 D.蛋白质 3.“建设美丽中国”是新时代的目标。下列做法不利于减少环境污染的是 【 】 A.回收各种废弃塑料 B.开发和利用新能源 C.工业废水任意排放 D.积极植树、造林、种草 4.下列物质在氧气里燃烧,生成物为白色固体的是 【 】 A.硫 B.镁条 C.铁丝 D.木炭 5.下列各组元素中,元素符号的第一个字母不相同的一组是 【 】 A.锰、钛 B.氩、金 C.铅、铂 D.氦、汞 6.下列有关水的说法正确的是 【 】 A.冰水共存物属于混合物 B.水是由氢元素和氧元素组成的化合物 C.将硬水过滤可得到软水 D.凡是有水生成的反应一定是中和反应 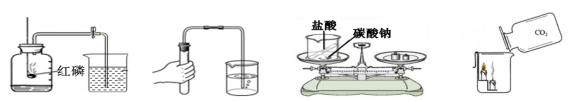 7.下列实验设计不能达到其对应实验目的的是 【 】 7.下列实验设计不能达到其对应实验目的的是 【 】A.测定空气里 B.检查装置的 C.验证质量守恒定律 D.证明CO2密度 氧气的含量 气密性 比空气的大 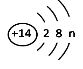 8.硅是信息技术的关键材料。右图为硅的原子结构示意图, 下列说法正确的是 【 】 A.硅属于稀有气体元素 B.图中n的值为8 C.硅的相对原子质量为14 D.硅元素位于第三周期 9.室温时将少量干冰放入塑料袋中并密封,塑料袋会快速鼓起,其原因是 【 】 A.分子的体积变大 B.分子分解变成了原子 C.分子的间隔变大 D.分子由静止变为运动 10.下列区分物质的方法或试剂不正确的是 【 】 A.用带火星的木条区分氧气和氮气 B.用熟石灰区分氯化铵和氯化钾 C.灼烧后闻气味区分羊毛线和腈纶线 D.用酚酞溶液区分硫酸和硫酸钠溶液 1l.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是【 】 ①称量的氯化钠固体中含有不溶性杂质; ②用量筒量取水时仰视读数; ③往烧杯中加水时有水洒出; ④将配制好的溶液装入试剂瓶中时有少量溅出。 A.①② B.①③ C.②④ D.③④ 12.过氧化钠(Na2O2)可作呼吸面具中氧气的来源,它与二氧化碳反应后的生成物为【 】 A.Na2CO3和H2 B.Na2O和O2 C.NaOH和O2 D.Na2CO3和O2 13.甲、乙、丙有如右图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),下列各组物质按照甲、乙、丙的顺序不符合要求的是 【 】 A.C、CO、CO B.H2O2、H2O、O2 C.KOH、K2CO3、KNO3 D.Fe2O3、FeCl3、Fe(OH)3 14.有Mg、Al、Zn的混合物共7.2g,与足量盐酸反应,生成H2的质量可能是 【 】 A.0.2g B.0.6g C.0.8g D.0.9g 二、填空题(本题包括6个小题,每空1分,共16分) 15.人体中含量最高的金属元素是__________;在尿素、硫酸钾、磷酸二氢铵三种化肥中,属于复合肥料的是____________________。 16.乙醇完全燃烧的化学方程式为________________________________________;高压水枪灭火所依据的灭火原理是______________________________________;氢气作燃料的优点是_______________________________________(答出一条即可)。 17.铜丝作导线是利用了其良好的__________性;铁锈(主要成分是Fe2O3)可用除去,该反应的生成物为H2O和____________________;铝制品耐腐蚀是因其表面生成了致密的氧化铝薄膜,该反应的化学方程式为______________________________。  18.右图是甲、乙两种固体的溶解度曲线。甲和乙的溶解度 18.右图是甲、乙两种固体的溶解度曲线。甲和乙的溶解度相等时的温度为_________℃;t2℃时,分别用甲、乙的固 体配制相同质量甲、乙的饱和溶液,所需要水的质量关系 为甲_______乙(填“大于”、“小于”或“等于”); t2℃时, 将75g甲的饱和溶液与50g水混合后所得溶液中溶质的 质量分数为_________。 19.A~E均为初中化学常见的物质,它们之间的关系如右图所示(部分物质已经略去)  已知A是目前世界上年产量最高的金属;B是胃酸的主要 已知A是目前世界上年产量最高的金属;B是胃酸的主要成分;C中金属元素的质量分数为40%,其水溶液呈蓝色, 常用来配制农药波尔多液;D属于碱;E属于盐。则C的 化学式为_____________;A与B反应的化学方程式为 _____________________________________________; E转化为D的化学方程式为____________________________________________。 20.碱式碳酸铜[Cu2(OH)2CO3]受热分解生成氧化铜、水和二氧化碳,反应的化学方程式 为_____________________________________________;充分加热24g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3:4,则该反应生成水和二氧化碳的质量之和为__________g。  三、简答题(本题包括4个小题,共10分) 三、简答题(本题包括4个小题,共10分)21.(2分)右图是某反应的微观示意图。 (1)写出图中单质的化学式。 (2)写出该反应的化学方程式。 22.(2分)将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤, 可以得到溶液和固体。 (1)写出会导致溶液质量变小的有关反应的化学方程式。 (2)若所得溶液中只含有一种溶质,请分析所得固体的成分。 23.(3分)下图是实验室制取气体的常用装置。  (1)写出一个用A装置制取O2的化学方程式。 (2)B和C装置均可制取CO2,与B相比较,C的主要优点是什么? (3)用试管采用排空气法收集H2 ,请在D处方框中画出装置图(只画试管和导气管)。 24.(3分)下图装置可以做CO还原Fe2O3的实验并检验该反应的气体生成物。已知由一氧化碳发生装置得到的CO中混有杂质CO2和H2O。 (1)写出B装置玻璃管内反应的化学方程式。 (2)从环保角度考虑,请写出一种尾气处理方法。 (3)若没有A装置,则该实验不能达到检验气体生成物的目的,请说明原因。 四、综合应用题(共10分) 25.酸、碱、盐在生产和生活中有广泛的应用。 (1)焙制糕点所用发酵粉中含有碳酸氢钠,其俗名为___________(填字母代号)。 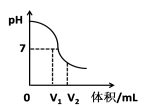 a.纯碱 b.烧碱 c.苏打 d.小苏打 a.纯碱 b.烧碱 c.苏打 d.小苏打(2)右图是氢氧化钠溶液与硫酸反应时溶液pH变化的示意图。 ①根据图示判断,该实验是将_______________(填“氢氧 化钠溶液”或“硫酸”)滴加到另一种溶液中。 ②滴人溶液体积为Vml时,溶液屮的溶质为____________。 (3)为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了以下方案: 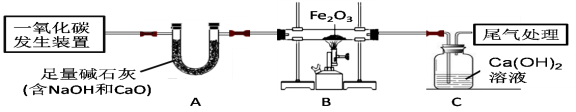  ①过滤用到的玻璃仪器有烧杯、玻璃棒和_______________。 ②写出加入Ba(OH)2溶液时反应的化学方程式。(提示:微溶物不形成沉淀) ③溶液X中含们哪些杂质?请设计实验加以证明。(简要写出实验步骤和现象) (4)为测定某石灰石样品中碳酸钙的质量分数,称取10g石灰石(杂质不参加反应) 放人烧杯中,加入100g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总 质量为106.7g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数。   化学试卷 第1页 (共4页) (责任编辑:admin) |
