模块一:金属与酸的反应
一、反应条件
(1)金属必须是氢前金属
(2)在初中阶段,酸一般指盐酸或稀硫酸,若是硝酸或浓硫酸,因其具有较强的氧化性,与金属反应时一般不生成氢气。
二、反应快慢
金属Mg、Al、Fe、Zn分别与酸溶液反应,产生氢气的速率与下列因素有关:
(1)金属的状态:其他条件相同时,粉末状金属比块状金属反应速率更快;
(2)酸的浓度: 其他条件相同时,金属和浓度较大的酸的反应速率较快;
(3)反应温度:其他条件相同时,金属和酸在较高的温度下反应速率更快;
(4)金属活动性顺序:其他条件相同时,金属活动性强的金属和酸反应的速率更快。
三、反应多少
金属Mg、Al、Fe、Zn分别与酸溶液反应
(1)等量金属与足量酸反应产生氢气(或消耗酸)的质量由多到少:
Al>Mg>Fe>Zn
推论:
①等质量的+2价金属与足量酸反应,产生氢气的质量与金属的相对原子质量成反比。
②等质量的金属与足量的酸反应,如果产生的氢气一样多,则酸全部反应完,金属不一定,可能都有剩余,或者相对原子质量最大的恰好反应完,其他金属有剩余。
相关图像:
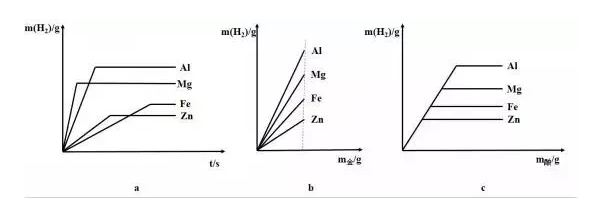
a:
横坐标:反应时间;纵坐标:氢气质量(Al>Mg>Fe>Zn)
起点:当时间为0时,产生的氢气质量为0
趋势:氢气的质量随时间的增加先增加后不变(金属完全反应)
拐点:对应金属恰好完全反应的点Mg>Al>Zn>Fe
(金属活动性越强,反应越快)
b:
横坐标:金属的质量;纵坐标:氢气质量(Al>Mg>Fe>Zn)
起点:当金属的质量为0时,产生的氢气质量为0
趋势:氢气的质量随酸质量的增加而增加
拐点:无Al>Mg>Fe>Zn
(金属的价量比越大,斜率越大)
价量比:化合价与相对分子质量之比
c:
横坐标:酸的质量;纵坐标:氢气质量(Al>Mg>Fe>Zn)
起点:当酸的质量为0时,产生的氢气质量为0
趋势:氢气的质量随酸质量的增加先增加后不变(金属完全反应)
拐点:对应金属恰好完全反应的点相同
(消耗相同质量的酸,产生相同质量的氢气)
(2)足量金属与等量酸反应,产生的氢气一样多,消耗金属的质量:
Al
相关图像:
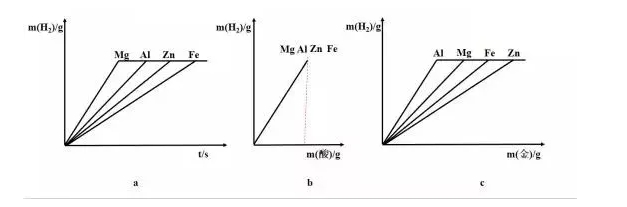
a:
横坐标:反应时间;纵坐标:氢气质量(相等)
起点:当时间为0时,产生的氢气质量为0
趋势:氢气的质量随时间的增加先增加后不变(酸完全反应)
拐点:对应酸恰好完全反应的点Mg>Al>Zn>Fe
(金属活动性越强,反应越快)
b:
横坐标:酸的质量;纵坐标:氢气质量(相等)
起点:当酸的质量为0时,产生的氢气质量为0
趋势:氢气的质量随酸质量的增加而增加至酸完全反应
拐点:无酸恰好完全反应相同
(消耗相同质量的酸,产生相同质量的氢气)
c:
横坐标:金属质量;纵坐标:氢气质量(相等)
起点:当金属质量为0时,产生的氢气质量为0
趋势:氢气的质量随金属质量增加先增加后不变(酸完全反应)
拐点:对应酸恰好完全反应的点Al>Mg>Fe>Zn
(金属的价量比越大,斜率越大)
模块二:金属与盐的反应
一、多种金属与盐溶液反应
(1)活动性强的金属可以把活动性弱的金属从它的盐溶液中置换出来(K、Ca、 Na除外)
(2)反应顺序:金属活动性强的金属先置换,完全反应后,金属活动性弱的金属才开始反应
例如:金属Ag、Fe、Zn与Cu(NO3)2溶液
Zn的活动性顺序最强,先去置换铜,Zn反应完后,如果Cu(NO3)2还有,Fe才开始去置换,Ag的活动性比Cu弱,不参与置换。
二、多种盐溶液与金属反应
反应顺序:金属活动性弱的金属先被置换出来,完全反应后,金属活动性强的金属才开始被置换出来。
例如:金属Fe与Cu(NO3)2、AgNO3和Zn(NO3)2
Fe先置换活动性最弱的Ag,完全反应后如果有剩余再置换Cu,不能置换Zn
(责任编辑:admin) |


