一、酸及酸的化学性质
酸在水溶液中能解离出氢离子(H+)和酸根离子。常见的酸有①盐酸(HCl)②硫酸(H2SO4) ③硝酸(HNO3)④醋酸(CH3COOH)
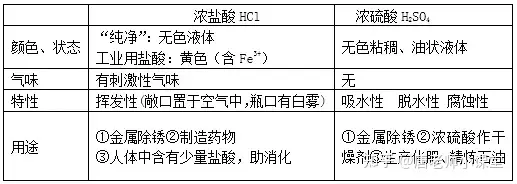
①紫色石蕊试液遇酸变红,无色酚酞试液遇酸不变色。
②活泼金属+酸盐+氢气(注:此处酸不包括浓硫酸和硝酸)
Zn+H2SO4=ZnSO4+H2 Zn+2HCl=ZnCl2+H2
Fe+H2SO4=FeSO4+H2 Fe+2HCl=FeCl2+H2
2Al+3H2SO4=Al2(SO4)3+3H2
2Al+6HCl=2AlCl3+3H2
③金属氧化物+酸盐+水
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+H2SO4=CuSO4+H2O
CuO+2HCl=CuCl2+H2O
④碱+酸盐+水
NaOH+HCl=NaCl+H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
3HCl + Al(OH)3 = AlCl3 + 3H2O
⑤*盐+酸新盐+新酸
AgNO3+HCl=AgCl+HNO3
BaCl2+H2SO4=BaSO4+2HCl
二、碱及碱的化学性质
碱由离子构成,碱在水溶液中能解离出金属离子和氢氧根离子(OH-)。
常见的碱有氢氧化钠(NaOH) 、氢氧化钙 Ca(OH)2、氨水(NH3·H2O)等。
1.氢氧化钠、氢氧化钙的物理性质、用途
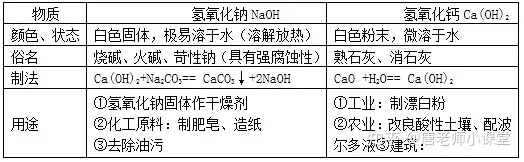
2.碱的化学性质
紫色石蕊试液遇碱溶液变蓝,无色酚酞试液遇碱溶液变红。
①酸性氧化物+碱盐+水
2NaOH+CO2=Na2CO3+H2O
*2NaOH+SiO2=Na2SiO3+H2O
Ca(OH)2+CO2=CaCO3+H2O
②酸+碱盐+水(中和反应)
③*盐+碱新盐+新碱(反应物均可溶)
2NaOH+CuSO4=Na2SO4+Cu(OH)2
三、盐的性质
1.常见的盐
盐由离子构成,组成里含有金属离子(或NH4+)和酸根离子的一类化合物。
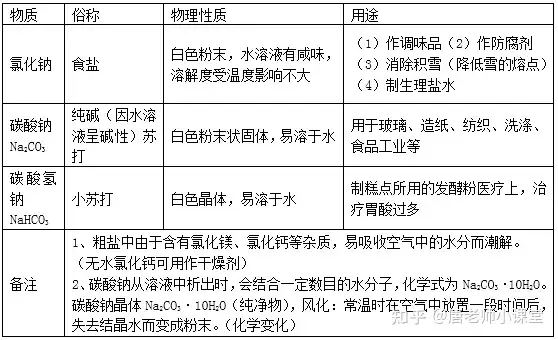
2.粗盐提纯
去除粗盐中不溶性杂质。
3.盐的化学性质
①盐溶液+金属新盐+新金属(按金属活动性顺序)
CuSO4+Zn=ZnSO4+Cu
CaCO3+2HCl=CaCl2+H2O+CO2
Na2CO3+2HCl=2NaCl+H2O+CO2
NaHCO3+HCl=NaCl+H2O+CO2
盐溶液+碱溶液新盐+新碱(必有一个是沉淀)
Ca(OH)2+Na2CO3==CaCO3+2NaOH(明星反应)
3NaOH+FeCl3=3NaCl+Fe(OH)3
盐溶液+盐溶液新盐+新盐(必有一个是沉淀)
CaCl2+Na2CO3=CaCO3+2NaCl
AgNO3+NaCl=AgCl+NaNO3
四、明确复分解反应发生的本质
复分解反应:由两种化合物(通常为酸碱盐)相互交换成分,生成另外两种化合物的反应。
通式:AB+CD=AD+CB
发生的条件:生成物中如果有、或有H2O(稳定、难溶、难电离物质)
注意:碱与氧化物的反应不属于复分解反应
对于复分解反应的三大特点也是同学们必须要记住的,第一反应物,生成物均只有两种化合物。第二,发生反应的两种化合物相互交换成分,三个元素的化合价在反应的前后均不发生改变,同学们在判断是否是复分解反应时,只需要依据以上的条即可辨别。
五、熟记酸、碱、盐的溶解性口诀
碱溶氨、钠、钾、钡、钙(俺拿假被盖)
钾钠铵(铵盐)硝(硝酸盐)全都溶。
硫酸盐不溶钡和铅;氯化物不溶银亚汞,碳酸盐只溶钾钠铵。
六、几个常见离子的检验
1.Cl-离子的检验 (选)
取少量样品于试管中,滴加AgNO3溶液和稀HNO3有不溶于稀硝酸的白色沉淀生成,样品含有Cl-, AgNO3+KCl=AgCl+KNO3
2.SO42-离子的检验 (选)
取少量样品于试管中,滴加Ba(NO3)2溶液和稀HNO3有不溶于稀硝酸的白色沉淀生成,样品含有SO42-, Ba(NO3)2+H2SO4=BaSO4+2HNO3
3. CO32-离子的检验
取少量样品于试管中,滴加稀HCl,将生成的气体通入澄清石灰水有无色气体生成,该气体使澄清石灰水变浑浊,样品含有CO32-,
K2CO3+2HCl=2KCl+CO2+H2O
CO2+Ca(OH)2=CaCO3+H2O
4.检验NH4+(选)
取少量待检物于洁净的试管中,滴入适量NaOH溶液并加热,有使湿的红色石蕊试纸变成蓝色的气体产生。
5、鉴别稀盐酸和稀硫酸
分别取少量待检液体于两支洁净的试管中,各滴入几滴BaCl2溶液,有白色沉淀产生的原溶液是稀硫酸,无现象产生的原溶液是稀盐酸。
七、常见俗称、成分和化学式
生石灰——CaO 熟石灰——Ca(OH)2
石灰石、大理石——CaCO3食盐——NaCl
火碱、烧碱、苛性钠——NaOH 纯碱、苏打——Na2CO3 小苏打——NaHCO3
铁锈、赤铁矿——Fe2O3 磁铁矿——Fe3O4 金刚石、石墨——C 干冰——CO2 冰——H2O 天然气(甲烷)——CH4
酒精(乙醇)——C2H5OH 醋酸(乙酸)——CH3COOH
八、常见物质的颜色
红色的固体——Cu、Fe2O3、P(红磷)
黑色的固体——C、CuO、Fe3O4、FeO、MnO2
白色的固体——KClO3、P2O5、P(白磷)、CuSO4(无水硫酸铜)、KCl、NaCl等
暗紫色的固体——KMnO4
淡黄色的固体——S
蓝色晶体——CuSO4•5H2O
蓝色沉淀——Cu(OH)2
红褐色沉淀——Fe(OH)3
白色沉淀(不溶于酸)——BaSO4、AgCl
白色沉淀(碳酸盐)——CaCO3、BaCO3
白色沉淀(碱)——Mg(OH)2、Al(OH)3
蓝色溶液——CuSO4、Cu(NO3)2等含Cu2+溶液
浅绿色溶液——FeSO4、FeCl2等含Fe2+溶液
棕黄色溶液——FeCl3、Fe2(SO4)3等含Fe3+溶液
对于初中阶段酸碱盐的学习,其包含的内容量还是比较多的,那么在学习当中想要快速的掌握这部分的内容,那么对其全面的了解外,还要针对每一部分的内容进行细致的分析,特别其中涉及到的一些简单的实验能也能够帮助大家快速的掌握酸碱盐各部分的性质。其中重要的一些化学方程式。记忆的口诀都是大家在学习或复习当中比较重要的学习内容。
(责任编辑:admin) |