|
例析金属与酸反应的图像题 江苏省兴化楚水实验学校 陈金健  一般情况下,活泼金属可以与稀盐酸、稀硫酸等稀酸溶液发生反应生成氢气。涉及金属与酸反应问题的图像题,侧重于考查金属的活动性、金属的相对原子质量、氢气的质量(或体积)、溶液的质量、溶质质量分数等相关量的变化关系。解答这类题的关键是,读懂图像本意,审清图像内涵。准确理解并应用图像中的相关信息,正确解题。 一般情况下,活泼金属可以与稀盐酸、稀硫酸等稀酸溶液发生反应生成氢气。涉及金属与酸反应问题的图像题,侧重于考查金属的活动性、金属的相对原子质量、氢气的质量(或体积)、溶液的质量、溶质质量分数等相关量的变化关系。解答这类题的关键是,读懂图像本意,审清图像内涵。准确理解并应用图像中的相关信息,正确解题。如图1,图中横坐标代表时间,纵坐标代表生成氢气的质量。当金属与稀酸溶液反应时,随着反应的进行,生成氢气的质量越来越大,此时在图像上表现为一条上升的直线(如图1中OA段所示 ),且生成氢气越快,这条直线的斜率越大(即“坡度越陡”)。因此,从图像上看生成氢气的快慢只须看“坡度陡、坡度缓”,“坡度越陡”表示生成氢气越快,线段OA的斜率与金属的活动性强弱有关。金属活动性越强,线段斜率越大。“坡度越缓”表示生成氢气越慢,金属活动性越弱,线段斜率越小。当金属与稀酸溶液充分反应后,生成氢气的质量将不再变化,此后在图像上表现为一条水平直线(如图1中的AB段所示)。生成氢气越多,这条直线表现在图像上就越高。因此,从图像上看生成氢气的多少,只须看“线高、线低”,“线越高”表示生成氢气越多,“线越低”表示生成氢气越少。 综上所述,解决这类问题时,一般需要用到下列规律: 1.在温度、金属颗粒大小和稀酸溶液溶质质量分数一定的条件下,金属的活动性越强,生成氢气就越快;生成氢气越快,说明金属的活动性就越强。 2.当金属的化合价相同时,对于相同质量的金属,金属的相对原子质量越大,生成的氢气越少;生成的氢气越多,金属的相对原子质量越小。  例1.锌和稀硫酸反应生成氢气,几次实验的锌的用量不等,但稀硫酸的用量相同。锌的用量(X轴),生在氢气的体积(Y轴)(在同温同压下测定)关系如图2,下列关于实验结果描述错误的是( ) 例1.锌和稀硫酸反应生成氢气,几次实验的锌的用量不等,但稀硫酸的用量相同。锌的用量(X轴),生在氢气的体积(Y轴)(在同温同压下测定)关系如图2,下列关于实验结果描述错误的是( )A.线段AB(包括A点)表示锌过量、硫酸已耗尽 B.线段AB(不包括A点)表示锌过量、硫酸已耗尽 C.线段OA(包括A点)表示锌和过量的硫酸反应 D.线段OA(不包括A点)表示锌和过量的硫酸反应  解析:一定质量的锌与足量的稀硫酸充分反应,图2中A点表示某一时刻,反应刚好停止。线段OA(包括点A)表示金属和过量的稀硫酸反应。线段AB(不包括点A)表示金属已经反应完,而稀硫酸过量。不过,值得我们注意的是,如果是足量的锌与一定量的稀硫酸充分反应时,那么线段OA(包括点A)则表示过量的金属和稀硫酸反应。线段AB(不包括点A)表示稀硫酸已经消耗完,而锌过量。 解析:一定质量的锌与足量的稀硫酸充分反应,图2中A点表示某一时刻,反应刚好停止。线段OA(包括点A)表示金属和过量的稀硫酸反应。线段AB(不包括点A)表示金属已经反应完,而稀硫酸过量。不过,值得我们注意的是,如果是足量的锌与一定量的稀硫酸充分反应时,那么线段OA(包括点A)则表示过量的金属和稀硫酸反应。线段AB(不包括点A)表示稀硫酸已经消耗完,而锌过量。解答:B、D 如图3,金属A的活动性要比金属B的活动性强。如果金属A、B与相同质量分数的酸溶液反应后生成的化合物中元素化合价相同( 如同为+2价等)那么,生成氢气的体积越多或质量越大,则该金属的相对原子质量越小。图3中金属B的相对原子质量小于金属A的相对原子质量。  足量的A、B两种金属同时分别放入两份溶质质量分数相同的少量稀盐酸中,如果反应后出现一种金属有剩余或两种金属都有剩余,而稀盐酸完全消耗了,那么它们生成氢气的体积(或质量)相等,如图4所示。 足量的A、B两种金属同时分别放入两份溶质质量分数相同的少量稀盐酸中,如果反应后出现一种金属有剩余或两种金属都有剩余,而稀盐酸完全消耗了,那么它们生成氢气的体积(或质量)相等,如图4所示。练一练 将物质的量相等的铝粉和铁粉分别与同体积、同浓度的稀硫酸反应。反应情况如图5所示。有关叙述中正确的是( ) 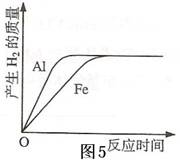 A.铝粉、铁粉和硫酸均有剩余 A.铝粉、铁粉和硫酸均有剩余B.铝粉、铁粉均反应完,硫酸有剩余 C.硫酸、铝粉均反应完,铁粉有剩余 D.硫酸、铁粉均反应完,铝粉有剩余  例2. 某探究小组的同学对金属的性质很感兴趣,探究金属的活泼性。取等质量的A、B金属,分别投入溶质质量分数相同的足量的盐酸中,生成氢气的质量(m)与时间(t)的关系如图6(已知A、B元素在生成物中的化合价相同) 例2. 某探究小组的同学对金属的性质很感兴趣,探究金属的活泼性。取等质量的A、B金属,分别投入溶质质量分数相同的足量的盐酸中,生成氢气的质量(m)与时间(t)的关系如图6(已知A、B元素在生成物中的化合价相同)1.由图6分析,甲、乙、丙三位同学的对话正确的是( ) 甲:时间t1时,产生氢气的质量A<B 乙:到时间t2时,金属均有剩余 丙:两种金属原子的相对原子质量A<B 2.结论:金属A、B的活泼性强弱关系是( ) 解析:金属与酸反应涉及的量有:①金属的质量;②金属元素在反应中显示的化合价;③金属的相对原子质量;④金属的活动性;⑤产生氢气的量;⑥产生氢气的时间;⑦酸的量。这些量之间存在如下关系: 1.当金属的化合价相同时,对于相同质量的金属,金属的相对原子质量越大,生成的氢气越少;生成的氢气越多,金属的相对原子质量越小。 2.在温度、金属颗粒大小和稀酸溶液溶质质量分数一定的条件下,金属的活动性越强,生成氢气就越快;生成氢气越快,说明金属的活动性就越强。可通过曲线的斜率来判断金属的活动性,斜率越大,反应的速率越快,则金属的活动性越强。解决这类问题有时要讨论两种情况: 1.如果酸足量,由于A、B的相对原子质量不同,则产生氢气的量不同; 2.如果酸不足,产生氢气的量相同,相对原子质量小的金属一定过量,相对原子质量较大的金属可能过量,也可能正好完全反应。本题中等质量的A、B金属,分别投入溶质质量分数相同的足量的盐酸中。由图示产生氢气的量不相等,属于第一种情况。 解答:1、甲、丙 2、 A<B 练一练 等质量的镁、锌、铁分别跟足量的稀硫酸在室温下起反应,图7中能够正确反映产生氢气质量m与反应时间t关系的图像为( )   练一练 将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图8所示。根据图中所提供的信息,得出的结论正确的是( )(A、B、C在生成物中均为+2价) 练一练 将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图8所示。根据图中所提供的信息,得出的结论正确的是( )(A、B、C在生成物中均为+2价) A.放出H2的质量是A>B>C B.金属活动性顺序是A>B>C C.反应速率最大的是A D.相对原子质量是C>B>A  练一练 将等质量的镁、铁、锌,分别放入三份溶质质量分数相同的稀盐酸中,反应生成的H2质量与反应时间的关系如图9所示。根据图中的信息,作出的判断不正确的是( ) 练一练 将等质量的镁、铁、锌,分别放入三份溶质质量分数相同的稀盐酸中,反应生成的H2质量与反应时间的关系如图9所示。根据图中的信息,作出的判断不正确的是( )A.图线x表示镁的反应情况 B.铁消耗的稀盐酸质量最大 C.镁、锌一定过量,铁可能反应完 D.镁一定过量,锌、铁可能反应完  我们在讨论金属与酸反应的图像问题时,一定要分清图像中X、Y轴所表示的具体含义,因为变换了X、Y轴的内容,所对应的图像就会出现不同的情形。如果X轴表示参加反应的金属的质量, Y轴表示生成的氢气的质量,一定量的不同金属与足量的酸进行反应,如 图10所示。假设三种金属分别为铝、镁、铁,你能找出其中代表铁的线条吗? 我们在讨论金属与酸反应的图像问题时,一定要分清图像中X、Y轴所表示的具体含义,因为变换了X、Y轴的内容,所对应的图像就会出现不同的情形。如果X轴表示参加反应的金属的质量, Y轴表示生成的氢气的质量,一定量的不同金属与足量的酸进行反应,如 图10所示。假设三种金属分别为铝、镁、铁,你能找出其中代表铁的线条吗?这时,我们可采取以下方法:1、在图像上画一条平行于X轴的直线与三个线条交于不同的三个点,比较这三个点的横坐标数值的大小,数值越大,表示产生等质量的氢气时,消耗的金属质量越多,数值越小,表示产生等质量的氢气时,消耗的金属质量越少;2、在图像上画一条平行于Y轴的直线与三个线条交于不同的三个点,比较这三个点的纵坐标数值的大小,数值越大,表示相等质量的金属完全反应后,产生的氢气越多;数值越小,表示相等质量的金属完全反应后,产生的氢气越少。通过以上分析,我们不难看出,线条C表示的金属是铁。 练一练 图11表示Fe、Zn、Mg、Al分别跟稀盐酸反应制取氢气的质量(m)与所用的金属质量(M)之间的关系图,其中正确的是 ( )  刚才提到,我们在讨论金属与酸反应的图像问题时,一定要分清图像中X、Y轴所表示的具体含义,因为变换了X、Y轴的内容,所对应的图像就会出现不同的情形。进行变式训练时,有时还会出现如下的情况。  例3.向一定量的铁粉中逐滴加入稀硫酸至过量,图12是反应过程中某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示( ) 例3.向一定量的铁粉中逐滴加入稀硫酸至过量,图12是反应过程中某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示( )A.消耗铁粉的质量 B.生成硫酸亚铁的质量 C.溶液的总质量 D.生成氢气的质量 解析:根据金属与酸反应的原理与过程,图中确定了X轴的含义,表示稀硫酸的质量,那么一段时间后,消耗铁粉的质量从无到有,渐渐增多,完全消耗后,不再变化。生成硫酸亚铁的质量也是从无到有,渐渐增多,反应停止后,不再变化。生成氢气的质量也是从无到有,渐渐增多,反应停止后,不再变化。而溶液的质量一开始不应该是0,并且反应后溶液的质量一直在增加。所以Y轴有可能是消耗铁粉的质量、生成硫酸亚铁的质量、生成氢气的质量,Y轴不可能表示溶液的总质量。 解答:C  练一练 如图13表示等质量的金属Mg和Al分别与足量且质量分数相等的稀硫酸反应,下列叙述正确的是( ) 练一练 如图13表示等质量的金属Mg和Al分别与足量且质量分数相等的稀硫酸反应,下列叙述正确的是( )A.X表示反应所用时间,Y表示生成氢气的质量 B.X表示生成氢气的质量,Y表示反应所用时间 C.X表示滴加稀硫酸的质量,Y表示生成氢气的质量 D.X表示参加反应的金属的质量,Y表示生成氢气的质量 提示:质量相等的Mg和Al与足量且质量分数相等的稀硫酸反应,Al产生氢气的质量比Mg产生氢气的质量多,同时Al消耗的硫酸质量也比Mg消耗的硫酸质量多。因为两种金属的活动性不相同,所以它们反应所需的时间也不相同。  例4.白铁是镀锌的铁,将白铁投入到稀硫酸溶液中,反应产生氢气的质量和反应时间的关系如图14,写出不同时间的化学方程式: 例4.白铁是镀锌的铁,将白铁投入到稀硫酸溶液中,反应产生氢气的质量和反应时间的关系如图14,写出不同时间的化学方程式:1.0-t1间不产生氢气: 2.t1-t2间产生氢气速度快: 3.t2后产生氢气较慢: 解析:因为白铁是镀锌的铁,白铁最外层的锌与空气中的氧气反应生成致密的氧化锌。将白铁投入到稀硫酸中,刚开始应是氧化锌与硫酸反应,此时没有气泡产生。反应的化学方程式是:ZnO+H2SO4=ZnSO4+H2O ,除去氧化锌后,锌与稀硫酸接触,快速反应产生氢气,化学方程式是:Zn+H2SO4=ZnSO4+H2↑,镀锌层消耗后,铁与稀硫酸接触,缓慢地产生氢气,反应的化学方程式是:Fe+H2SO4=FeSO4+H2↑。 解答:1.ZnO+H2SO4=ZnSO4+H2O 2.Zn+H2SO4=ZnSO4+H2↑ 3.Fe+H2SO4=FeSO4+H2↑ 练一练 将相等质量的锌粒(X)与锌粉(Y)投入到相同体积相同质量分数的足量稀盐酸中,充分反应。图15中能正确表示产生氢气的质量与反应的时间的关系的是( )  提示:等质量的锌粒与锌粉与足量的稀盐酸充分反应后,生成的氢气的质量应该项相等。反应物的颗粒大小影响了反应的速率,也就是反应所需的时间有区别,颗粒越小反应就越快,所需要的时间就越短。 练一练:1、C 2、A 3、A D 4、C 5、D 6、C 7、A (责任编辑:admin) |
