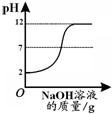
|
2011年北京市西城区九年级化学统一练习(二) 北京 李菁菁(供稿)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Zn 65 一、选择题(每小题只有一个选项符合题意。共25个小题,每小题1分,共25分。) 1.地壳中含量最多的金属元素是 A.氧 B.硅 C.铝 D.铁 2.下列图标中,表示“禁止烟火”的是  A B C D 3.下列变化中,属于物理变化的是 A.火药爆炸 B.衣服晾干 C.蜡烛燃烧 D.粮食酿酒 4.下列物质中,属于氧化物的是 A.SO2 B.H2SO4 C.O2 D.Al2(SO4)3 5.与元素的化学性质密切相关的是 A.原子核外电子层数 B.原子最外层电子数 C.原子核内中子数 D.相对原子质量 6.下列物质中,含有氧分子的是 A.二氧化碳 B.蒸馏水 C.空气 D.双氧水 7.二氧化铅(PbO2)是生产汽车蓄电池的电极材料,其中铅(Pb)元素的化合价是 A.-4 B.+1 C.+2 D.+4 8.下列化学用语书写正确的是 A.一氧化碳:Co B.铜离子:Cu+2 C.氢氧化镁:Mg(OH)2 D.氧化铝:AlO 9.下列各组中的俗名和化学名称均表示同一种物质的是 A.生石灰——氢氧化钙 B.酒精——乙醇 C.火碱——碳酸氢钠 D.食盐——氯化钾  10.根据右图R2-的离子结构示意图,推测m的值为 10.根据右图R2-的离子结构示意图,推测m的值为 A.10 B.16 C.18 D.20 11.下列解释错误的是 A.“酒香不怕巷子深”说明分子在不断运动 B.热胀冷缩说明分子大小随温度改变而改变 C.石油气经压缩后存放在钢罐中说明分子间有间隔 D.氢气在氧气中燃烧生成水,说明分子在化学变化中可以再分 12.右表是元素周期表的一部分。下列关于碳元素的叙述错误的是
A.该元素为非金属元素 B.该元素对应原子的质子数为6 C.含有该元素的化合物都是有机物 D.C60是由该元素组成的单质 13.下列叙述正确的是 A.水变成水蒸气,这一过程属于化学变化 B.通入二氧化碳的紫色石蕊溶液呈红色,说明二氧化碳显酸性 C.为了降低水的硬度,生活中常采用加热煮沸的方法处理硬水 D.配制100 g10%的氯化钠溶液的主要步骤是:称量、溶解、装瓶贴标签 14.法医常用马氏试砷法来证明是否砒霜中毒,其反应的化学方程式为: R + 8HCl + 4Zn = 4ZnCl2+ 3H2O + 2As + H2↑,则砒霜(R)的化学式为 A.As2O2 B.As2O C.AsO D.As2O3 15.下列实验现象的描述正确的是 A.木炭在氧气中燃烧生成二氧化碳 B.白磷在空气中燃烧生成白雾 C.镁条与稀盐酸反应有热量放出 D.点燃棉花和羊毛都产生烧焦羽毛气味 16.下列对燃烧和爆炸的认识错误的是 A.爆炸不一定是化学变化 B.可燃物与氧气接触面积越大,燃烧越剧烈 C.温度达到可燃物的着火点,即可发生爆炸 D.有易燃易爆物的场所,严禁穿化纤类衣服 17.下列关于“相等”的说法错误的是 A.化学反应前后分子个数一定相等 B.化合物中元素的正负化合价总数相等 C.原子中质子数与核外电子总数相等 D.溶液加水稀释前后溶质的质量一定相等 18.下列有关金属的说法正确的是 A.铁、铝、铜均为银白色 B.生铁炼成钢就是把生铁变为纯铁 C.铝在空气中不易被腐蚀是因为其化学性质稳定 D.在自行车支架上喷油漆既美观又防锈 19.下列对知识的整理错误的一组是
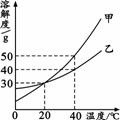 20.甲、乙两种固体的溶解度曲线如右图所示。下列说法中,正确的是 20.甲、乙两种固体的溶解度曲线如右图所示。下列说法中,正确的是A.40℃时,甲溶液的质量分数一定大于乙溶液的质量分数 B.当乙中混有少量甲时,可采用冷却热饱和溶液的方法提纯 C.20℃时,100 g甲的饱和溶液中溶质的质量是30 g D.20℃时,分别在100 g水中加入50 g甲、乙,加热到40℃,甲、乙溶液均为饱和溶液 21.有以下说法:①烧碱暴露在空气中质量会增加;②浓硫酸暴露在空气中溶质的质量分数会增大;③石灰水暴露在空气中溶液的质量会增加;④浓盐酸暴露在空气中溶质的质量分数会减小;⑤久置空气中的生石灰质量会增加。其中正确的是 A.①⑤ B.①②④ C.①④⑤ D.①③④⑤ 22.石头纸是一种新型、环保纸张,坚固且不易燃烧。它是将碳酸钙粉末加上15%的聚乙烯塑料和5%的胶合剂,经特殊工艺处理后制成。下列说法正确的是 A.聚乙烯塑料是一种天然有机高分子材料 B.石头纸的普遍应用不能减少对树木的砍伐 C.用稀盐酸和石灰水可检验出石头纸中是否含碳酸根 D.石头纸和普通纸都不易与氧气发生反应 23.下列4个坐标图分别表示4个实验过程中的某些变化,其中正确的是
24.20℃时,把少量生石灰放入盛有饱和石灰水的烧杯中。下列关于烧杯中溶液的叙述错误的是 A.溶剂的质量一定减小 B.溶质的质量一定减小 C.溶液一定变浑浊 D.溶质的质量分数一定减小 A.71︰75 B.71︰79 C. 80︰79 D. 81︰79 二、填空题(本题包括5道小题,共30分。) 26.(6分)水是生命活动中的重要物质。 (1)下表为某品牌营养素饮料标签的部分内容,请根据表中信息回答问题。
该饮料含有六大营养素中的 种;该饮料中的 元素对预防青少年佝偻病有益;该饮料pH为3.5,此饮料呈 性(填“酸”、“碱”或“中”)。 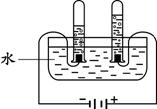 (2)右图为电解水的实验装置,负极产生的气体是 ,该反应的化学方程式为 。 (2)右图为电解水的实验装置,负极产生的气体是 ,该反应的化学方程式为 。(3)保护水资源是每个公民应尽的责任和义务。下列防止水污染的措施可行的是 。 A.抑制水中所有动植物生长 B.不任意排放工业废水 C.禁止使用农药和化肥 D.生活污水处理后再排放  27.(6分)在宏观、微观和符号之间建立联系是化学学习的特点。 27.(6分)在宏观、微观和符号之间建立联系是化学学习的特点。(1)上图中A是_____。 (2)在铜、氯化钠、二氧化碳三种物质中,由分子构成的是______。 (3)葡萄糖酸钙【化学式为(C6H11O7)2Ca】由______种元素组成,其中碳、氢元素的质量比为 。 (4)下图为某反应的微观示意图。 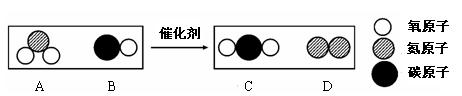 ① 该反应中B与D的质量比是______(结果用最简整数比表示)。 ② 对此反应的叙述正确的是______(填序号)。 a.反应前后各元素化合价均未改变 b.用同种元素可以组成不同物质 c.加入催化剂可提高产物质量 d.利用此反应可减少有毒气体的排放 28.(6分)工业上用CaSO4、NH3、CO2制备硫酸铵晶体(NH4)2SO4,过程如下图所示。 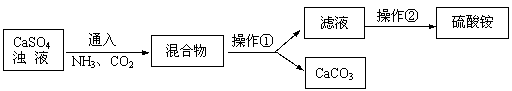 (1)硫酸铵在农业生产上的一种用途是______,它属于 (填“酸”、“碱”或“盐”)。 (2)操作①中需要使用的玻璃仪器有 ;从滤液中得到硫酸铵晶体,正确操作顺序是 → → (填序号)。 a.过滤 b.加热浓缩 c.冷却结晶 (3)用CaSO4、NH3、CO2制备硫酸铵的化学方程式是 。 29.(6分)金属在日常生活中随处可见,研究金属的性质可以更好地利用金属。 (1)铝、铁、铜是常见金属。下列生活用品中,主要利用金属导热性的是______(填序号)。  (2)“淬火”是金属热处理常用的方法。宝剑淬火过程中,铁在高温下和水蒸气发生反应生成四氧化三铁和另一种气体单质,此反应的化学方程式为 ,该反应属于基本反应类型中的 反应。 (3)将一定量铁粉加入到硫酸锌、硫酸铜的混合液中,充分反应后过滤。滤液中的溶质一定有 。 (4)取一定量镁、锌、铁三种金属,分别加入溶质质量分数相等的稀盐酸,充分反应后,生成氢气的质量相等。下列做法与此结果相符的是 (填序号)。 A.相同质量的三种金属与足量的稀盐酸反应 B.2.4 g镁、6.5 g锌、5.6 g铁与足量的稀盐酸反应 C.向足量的镁、锌、铁中加入稀盐酸的质量比为2︰3︰2 D.足量的三种金属与等量的稀盐酸反应 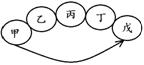 30.(6分)甲、乙、丙、丁、戊是初中化学常见的物质。下图中的五个圆分别表示这五种物质,用两圆相切表示这两种物质能发生反应,“→”表示物质间的转化关系(部分反应物、生成物及反应条件已略去)。 30.(6分)甲、乙、丙、丁、戊是初中化学常见的物质。下图中的五个圆分别表示这五种物质,用两圆相切表示这两种物质能发生反应,“→”表示物质间的转化关系(部分反应物、生成物及反应条件已略去)。(1)若单质甲粉末与化合物戊均为黑色固体,丙和无色气体丁反应可以生成甲。戊的化学式是 ,乙和丙反应的化学方程式是 。 (2)若甲是铜绿的主要成分碱式碳酸铜【化学式为Cu2(OH)2CO3】,甲与酸反应生成一种盐及两种氧化物丁和戊,乙是胃酸的主要成分,乙与丙、丙与丁反应均可生成戊且无明显现象。甲和乙反应的化学方程式是 ,丙和丁反应的化学方程式是 。 (3)若五种物质所含元素为H、C、O、Na、Ca、S中的两种或三种,甲与丙属于同一类物质,且相对分子质量由甲到戊依次增大。丙的俗称是 ,甲和丁反应的化学方程式是 。 三、实验题(本题包括3道小题,共19分。) 31.(5分)根据下图所示实验,回答问题。 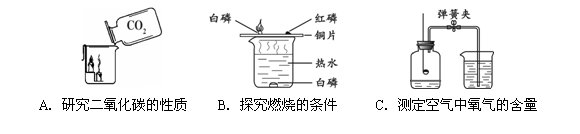 (1)实验A中观察到的现象是 ,说明相同条件下,CO2的密度比空气大,且 。 (2)实验B中只有铜片上的白磷燃烧,由此证明可燃物的燃烧条件是 。 (3)实验C中红磷要过量,其目的是 ,红磷燃烧的化学方程式是 。 32.(7分)课外小组同学在实验室进行一氧化碳还原氧化铁的实验。 【查阅资料】 Ⅰ.常温下,甲酸(HCOOH)是无色易挥发的液体,在浓硫酸作用下易分解。 甲酸分解的化学方程式为:HCOOH 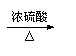 CO↑+ H2O。 CO↑+ H2O。Ⅱ.铁与氯化铁溶液在常温下发生反应生成氯化亚铁。 【实验设计及操作】 (1)利用下列装置完成用纯净、干燥的一氧化碳还原氧化铁实验,并检验气态产物。 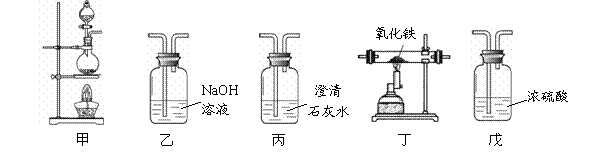 ① 若各步均反应完全,装置的连接顺序为_____→尾气处理(填序号)。 ② 实验时先点燃甲中的酒精灯,一段时间后再点燃丁中的酒精喷灯,目的是 ;装置乙的作用是 。 ③ 装置丁中观察到的现象是_____,反应的化学方程式是_____。 (2)为检验氧化铁是否反应完全,同学们设计如下实验方案:从装置丁中取出少量反应后的固体粉末于试管中,加入足量稀盐酸,若观察到有大量气泡产生且溶液变为浅绿色,则说明氧化铁已完全反应。上述判断是否正确,理由是_____。 33.(7分)有一包未知粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜六种物质中的四种。兴趣小组为确定其组成设计并进行如下实验。 【实验一】甲组同学进行定性探究。
【实验二】乙组同学进行定量探究。 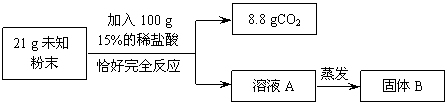 实验测得固体B中含15 g氯元素。试综合甲、乙两组同学的实验进行分析。 (1)乙组实验中一定发生的化学反应是:Na2CO3+ 2HCl=2NaCl + H2O+ CO2↑和 。 (2)该未知粉末的组成可能是 。 四、计算题(本题包括2道小题,共6分。) 34.(3分)摩托罗拉公司研发了一种由甲醇(CH3OH)为原料的新型手机电池。电池反应的原理为:2CH3OH + 3O2 + 4NaOH = 2Na2CO3 + 6H2O。若消耗了3.2 g甲醇,可生成多少克水? 35.(3分)现有Na2CO3和Na2SO4的固体混合物共18 g,将它放入98 g20%的H2SO4溶液中,充分反应后溶液呈酸性;向此酸性溶液中再逐滴加入84 g10%的Na2CO3溶液,恰好完全反应。计算所得溶液中溶质的质量分数。(计算结果精确到0.1%) 参考答案及评分标准 一、选择题(每小题只有1个选项符合题意。共25个小题,每小题1分,共25分。)
说明:除特别注明外,每空1分。其他合理答案参照本标准给分。 二、填空题(26~30小题,共30分。) 26.(6分)(1)4 钙 酸 (2)氢气 2H2O  O2↑+2H2↑(3)BD O2↑+2H2↑(3)BD 27.(6分)(1)原子 (2)二氧化碳 (3)4 72∶11 (4)①4∶1 ② bd 28.(6分)(1)作氮肥(答化肥得分) 盐 (2) 漏斗、玻璃棒 烧杯 b→c →a (3)CaSO4+2NH3+CO2+H2O =CaCO3+(NH4)2SO4(2分) 29.(6分)(1)② (2)3Fe +4H2O(气)  Fe3O4 +4H2 置换 Fe3O4 +4H2 置换(3)FeSO4、ZnSO4 (4)BD (2分) 30.(6分)(1) Fe3O4 Fe2O3+ 3H2SO4 = Fe2(SO4)3+ 3H2O(写氧化铁与盐酸反应等可得分) (2)Cu2(OH)2CO3+ 4HCl=2CuCl2 +CO2↑+3H2O 2NaOH + CO2=Na2CO3+H2O (3)熟石灰或消石灰 2NaOH+ H2SO4=Na2SO4+2H2O 三、实验题(31~33小题,共19分。) 31.(5分)(1)蜡烛由低到高逐次熄灭 不燃烧也不支持燃烧 (2)温度要达到可燃物的着火点和需要接触氧气 (3)充分消耗空气中的氧气 4P+5O2  2P2O5 2P2O5 32.(7分) (1)①甲→乙→戊→丁→丙 (2分,有错不得分) ②产生CO气体,排尽装置内的空气,防止加热爆炸 除去CO中的甲酸气体 ③红色粉末变成黑色 Fe2O3 + 3CO  2Fe + 3CO2 2Fe + 3CO2 (2)不正确,未反应的氧化铁与盐酸反应生成氯化铁溶液,氯化铁溶液与生成的铁反应,溶液也可变为浅绿色。 33.(7分)
综合甲、乙两组同学的分析: (1)CaCO3+ 2HCl=CaCl2 + H2O+ CO2↑ (2)Na2CO3 、NaCl、CaCO3、NaOH 或Na2CO3 、NaCl、CaCO3、CaO (2分) 四、计算题(34~35小题,共6分) 34.(3分) 解:设生成H2O的质量为x。 2CH3OH + 3O2 + 4NaOH == 2Na2CO3 + 6H2O 64 108 3.2 g x -----------------------------------1分 64∶108 =3.2 g∶x -----------------------------------------------1分 x = 5.4 g ---------------------------------------------1分 答:能生成 5.4 g的H2O。 35.(3分)解:设参加反应的Na2CO3的质量为x,生成Na2SO4的质量为y,生成CO2的质量为z。 Na2CO3 + H2SO4 = Na2SO4 + H2O+ CO2↑ 106 98 142 44 x 98 g×20% y z x =21.2 g y=28.4 g z=8.8 g --------------------------------------------1分 原固体混合物中Na2CO3质量为:21.2 g-84 g×10%=12.8 g Na2SO4总质量为:28.4 g+(18 g-12.8 g)=33.6 g --------------------------------------------1分 反应后所得溶液中硫酸钠的质量分数为: 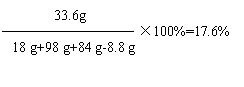 答:反应后所得溶液中硫酸钠的质量分数为17.6% (责任编辑:admin) |