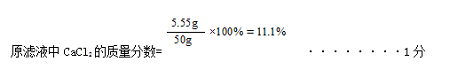|
北京市朝阳区九年级综合练习(一)化学 北京市 刘金辉
可能用到的相对原子质量 H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 Ca 40 Zn 65 一、选择题(每小题只有1个选项符合题意。共25个小题,每小题1分,共25分) 1.下列生活中的现象,属于化学变化的是 A.食物腐败 B.水结冰 C.夏季柏油路面“变软” D.冬季钢轨之间缝隙加大 2.下列食物中富含糖类的是  3.下列物质中,属于溶液的是 A.牛奶 B.豆浆 C.冰水 D.糖水 4.决定元素化学性质的是 A.核外电子数 B.中子数 C.最外层电子数 D.质子数 5.下列物质中,属于氧化物的是 A.NaCl B.MnO2 C.NaOH D.H2SO4 6.下列气体中,有毒的是 A.N2 B.O2 C.CO D.CO2 7.能与无色硝酸银溶液反应,使溶液变为蓝色的金属是 A.铝 B.铁 C.铜 D.银 8. 下列二氧化碳的用途不正确的是 A.供给呼吸 B.作气体肥料 C.用于灭火 D.生产碳酸饮料 9.某试验田的玉米叶色淡黄,有倒伏现象,你认为应施用的复合肥是 A.CO(NH2)2 B.KCl C.Ca(H2PO4)2 D.KNO3 10.下列物品是由有机合成材料制成的是
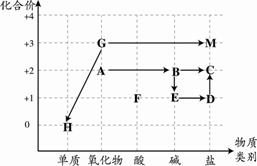
11.下列突发事件处理方法正确的是 13.某矿石样本含有如图所示的四种元素,该矿石中可能含有的物质是
14.下图是粗盐提纯的部分实验操作,其中不正确的是 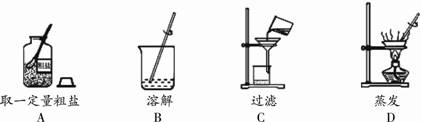 15.溶洞中存在的反应:CaCO3+CO2+H2O = Ca(HCO3)2,此反应属于
16.下列事实与对应的解释相符的是 A.空气能被压缩——分子体积可以变小 B.甘蔗甜,苦瓜苦——构成物质的分子不同 C.结冰的水不能流动——0℃以下,水分子不再运动 D.50mL水和50mL酒精混合后的总体积小于100mL——分子质量小 17. 奥司他韦(C16H28N2O4)可抑制流感病毒在人体内的传播,起到治疗流行性感冒的作用。下列对奥司他韦的说法不正确的是 A.从分类角度看:属于有机物 B. 从量的角度看:氢元素的质量分数约为20.5% C.从组成角度看:由碳、氢、氮、氧四种元素组成 D.从结构角度看:分子中碳、氢、氮、氧原子个数比为8:14:1:2 18.归纳与反思是学习化学的重要环节。下列各项归纳完全正确的是
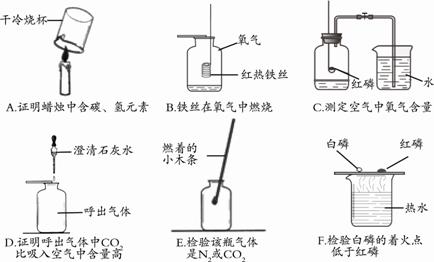
19.下列实验现象不正确的是 A.打开浓盐酸的试剂瓶盖,瓶口会出现白雾 B.生锈的铁钉放入无色稀硫酸中溶液变黄色 C.未密封保存的烧碱遇足量稀盐酸有气泡冒出 D.水通电时正极产生的气体燃烧发出淡蓝色火焰 20.下列由事实得出的结论正确的是
21.取一滤纸条,等间距滴10滴紫色石蕊溶液,然后装入玻璃管中(如图所示),两端管口同时放入分别蘸有浓氨水和浓盐酸的棉球,几秒后观察到图示现象。下列说法不正确的是  A.氨水的pH大于7 B.所有分子的运动速率都相等 C.氨分子和氯化氢分子在不断运动 D.酸、碱能使酸碱指示剂显示不同颜色 22. 除去下列物质中所含的少量杂质,方法正确的是
23.右图是某反应的微观示意图,下列说法不正确的是 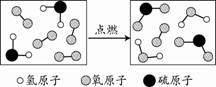 A.反应物中有单质 B.该反应为置换反应 C.生成物的分子个数比为1:1 D.参加反应的 24.化学小组设计实验探究碳酸钠、碳酸氢钠与盐酸反应过程中的吸、放热情况。操作步骤为:①向试剂1中加入试剂2,搅拌、测温 ②静置、测温 ③再加入试剂3,搅拌、测温、记录。得到以下数据:
下列说法中,不正确的是 A.碳酸钠溶水时放出热量 B.碳酸氢钠溶水时吸收热量 C.其它条件相同时,碳酸氢钠溶液与盐酸混合时放出的热量更多 D.实验中,若同一列试剂的温度及所取的量不同,则实验结论的可信度降低 25.下列选项的操作或反应所对应的曲线图正确的是 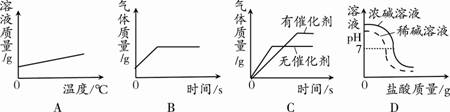 A.将饱和石灰水升温 B.一定量的锌粉与稀盐酸反应 C.等体积、等质量分数的过氧化氢溶液分解 D.向等体积不同质量分数的NaOH溶液中滴加相同质量分数的稀盐酸 二、填空题(共5个小题,共30分) 26.(6分)钠元素对人类生命和生活具有重要意义。 (1)如右图所示,钠元素的相对原子质量为 。  (2)钠元素广泛存在自然界中,亚硝酸钠(NaNO2)是一种常用的防腐剂,其中氮元素的化合价为 ;小苏打是发酵粉的主要成分,其化学式为 ;氯化钠在生活中常用于 。 (3)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3,反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X,则X的化学式 。 (4)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,汽车经撞击后,30毫秒内引发NaN3迅速分解生成两种单质,写出反应的化学方程式 。 27.(5分)能源、环境与生活和社会发展密切相关。 (1)常见的化石燃料包括煤、石油和 。 (2)下列关于能源与能量变化的叙述中,正确的是 。 A.汽油既是燃料,又是良好的溶剂 B.在化学反应中只有燃烧才能放出热量 C.人类利用的能量都是通过化学反应获得的 D.煤制成“蜂窝煤”是为了增大与空气的接触面积,使其燃烧充分 (3)为防止二氧化碳过多排放到空气中,在实际生产中经常利用NaOH溶液来“捕捉”CO2,流程图如下(部分条件及物质未标出)。 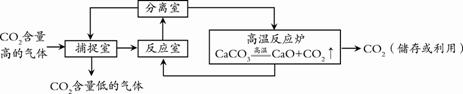 ①捕捉室内发生反应的化学方程式为____________________。 ②反应室内发生反应的化学方程式为________________________。 28.(6分)海水蕴藏着丰富的资源。 (1)海水中溶剂 是 。 (2)从海水中提取粗盐一般可采用 方法。 (3)下图是特殊情况下使用的应急净水器。利用该净水器将2000g含氯化钠3%的海水暴晒4小时,收集到500g可饮用水,此时剩余海水中氯化钠的质量分数为 。 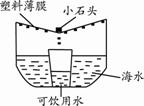 (4)利用氯化钠制备碳酸钠的同时可以得到氯化铵,下表为氯化铵的溶解度:
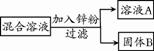
①向100 g水中不断加入氯化铵固体或改变温度,得到下图相应的溶液A~E。 溶液D是 (填“饱和”或“不饱和”)溶液,溶液E中析出晶体 g。 ②将盛有溶液E的小烧杯放入盛有水的大烧杯中,向大烧杯内加入NaOH固体,小烧杯内的固体溶解,原因是 29.(6分)金属结构和性质等是化学研究的重要内容。 (1)下图是铝的原子结构示意图。下列说法不正确的是 。 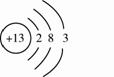 A.铝原子的质子数为13 B.化合物中铝元素通常显+3价 C.铝是地壳中含量最多的元素 D.铝可作导线是由于它具有良好的导电性
二、填空题(未标分数的空,每空1分,共30分) 26.(6分) (1)22.99 (2)+3 NaHCO3 调味品或融雪剂 (3)NH3 (4)2NaN3撞击2Na+3N2↑ 27.(5分) (1)天然气 (2)AD (3)①CO2+2NaOH=Na2CO3+H2O ②CaO+H2O=Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH(1个方程式1分) 28.(6分) (1)水 (2)蒸发溶剂 (3)4% (4)① 不饱和 9.2 ②氢氧化钠固体溶于水放热,使得氯化铵的溶解度增大而溶解(加点字含义必须有) 29.(6分) (1)C (2)3CO+Fe2O3高温2Fe+3CO2 (3)R>Fe>H>Cu (4)猜想2 取少量固体B于试管中,加入足量的稀盐酸(或稀硫酸),若有气泡产生则固体B的成分是Zn、Cu、Ag的混合物,若无气泡产生则固体B的成分是Cu、Ag的混合物。 (2分,写出一种情况得1分) 30.(7分) (1)熟石灰或消石灰 (2)吸水潮解,与二氧化碳反应变质 (3)Fe2O3+6HCl=2FeCl3+3H2O或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O (4)NaOH或NaOH和Ca(OH)2(2分,;漏答、错答不得分) (5)2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ (6)7 三、实验题(未标分数的空,每空1分,共19分) 31.(6分) (1)3Fe+2O2 点燃 Fe3O4 防止溅落的熔化物炸裂瓶底 (2)CO2+Ca(OH)2=CaCO3↓+H2O (3)铜片上的白磷燃烧红磷不燃烧 (4)ADE A:将烧杯倒转后倒入澄清石灰水 D:加一个在空气瓶中滴加澄清石灰水的对比实验 E:倒入澄清石灰水 32.(5分) (1)固体减少有气泡产生 液面上升,浑浊液体变澄清,有气泡冒出 (2)Zn和稀硫酸(合理答案得分) 干燥进入的气体 观察冒出气泡的速率 33.(8分) (1)【查阅资料】①2Na2O2+2CO2=2Na2CO3+O2 【设计方案】②C (2)CaCO3+2HCl=CaCl2+H2O+CO2↑ K2 |