|
2012年四川省沐川县初中化学模拟测试 四川省沐川县教研室 莫 春 可能用到的相对原子质量:K 39 Cr 52 O 16 Mg 24 Cl 35.5 Na 23 H 1 一、选择题。(本题共30小题。每小题2.5分。在每小题给出的四个选项中,只有一项是符合题目要求的) 17. 下列变化中主要发生物理变化的是  18. 据报道:“染色”馒头中添加柠檬黄铬酸铅(PbCrO4)会使人体致癌,已被明文禁用。已知铅元素(Pb)化合价为+2,则铬元素(Cr)的化合价为 A.+2 B.+3 C.+4 D. +6 19. 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容。下列关于“碳”元素的说法错误的是 A.“低碳生活”倡导低能量、低消耗,主要是为了减少CO2的排放量。 B. 有利于我国减少二氧化碳排放的最合理措施是大量进口石油,减少煤炭使用量 C. 天然气主要成分为甲烷,用天然气替代煤等固体燃料,其优点是污染少、方便 D. 将过多的二氧化碳和氢气在催化剂和加热的条件下反应,转化为水和甲烷可减缓大气中CO2含量的增加 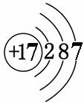 20. 右图是元素X的原子结构示意图。下列说法正确的是 20. 右图是元素X的原子结构示意图。下列说法正确的是 A.X属于金属元素 B.该原子的核外电子数为7 C.X与Na形成的化合物为NaX D.该原子最外电子层达到了稳定结构 21. 四位同学在一起讨论某种物质,请根据他们的讨论判断该物质是  A. Na2CO3 B. CaCO3 C. CaCl2 D. NaHCO3 22. “酒驾”是当前热门话题之一。喝酒不开车,开车不喝酒。酒后驾驶是一种违法行为,交巡警检查驾驶员是否饮酒的仪器里装有重铬酸钾(化学式为K2Cr2O7 )。下列关于重铬酸钾的说法正确的是 A. 它是氧化物 B. 含有K、Cr、O三种元素 C. 钾、铬、氧三种元素的质量比为 39:52:112 D. 重铬酸钾是由2个钾原子、2个铬原子、7个氧原子构成 23. 根据下表提供的信息,下列判断错误的是 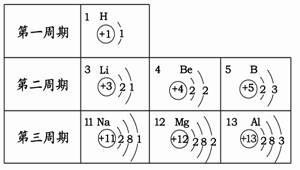 A. 元素所在的周期数等于其原子的电子层数 B. 原子序数与元素原子核电荷数在数值上相同 C. 第二、三周期元素的原子从左至右最外层电子数逐渐增多 D. 金属元素的原子,其最外层电子数一般少于4个,在化学反应中易得到电子,趋向达到相对稳定结构 24. 沐川依托穿城而过的沐溪河,结合“河、城、桥、景”四元素,正努力治理环境污染,加快城市美化建设,把沐川打造成乐山的绿色氧吧。下列说法错误的是 A. 县城街道两旁的部分餐馆换气扇全天对着街道吹,从用炊火源中释放出的CO、SO2等有害气体和烹饪菜肴时产生的油烟易使人患上肺炎、气管炎等呼吸道疾病 B. 县城的河堤两侧正在铺设管道,让生活污水集中流通,经处理后进入城外下游河道,这标志着城区的污水排放问题将达到很大程度的改善 C. 水泥厂周围常年烟尘弥漫,其主要成分是粉尘、燃料燃烧后产生的氮氧化物等。只要附近的居民平时带上口罩,对健康就不会有任何影响 D. 阴雨天气,气压较低的时候,纸厂周围常闻到弥漫在空气中的刺鼻臭味。这是纸厂在造纸过程中产生的臭气(甲硫醇、甲硫醚等气体)排放,该臭气属于混合物 25. X、Y、Z三种物质的近似pH如下图所示。下列说法错误的是 A. X一定是稀盐酸 B. 酚酞溶液遇Z溶液变红色 C. Y溶液是中性溶液 D. X溶液能使石蕊溶液变红 26. 有X、Y、Z三种金属,Y在常温下就能与氧气反应,X、Z在常温下几乎不与氧气反应;取大小相等的X、Z金属片,分别放入CuSO4溶液中,一段时间后,Z表面出现红色物质,X表面几乎无明显变化。根据以上实验事实判断,X、Y、Z三种金属的活动性由强至弱的顺序正确的是 A.Y>Z>X B.Z>X>Y C.X>Y>Z D.Y>X>Z 27. 下面是4位同学对“化学与健康”这一话题发表的见解,你认为正确的是 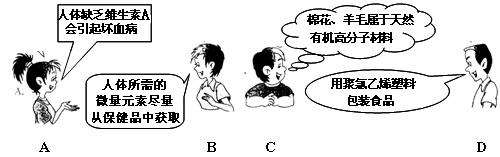 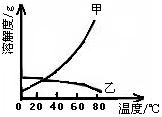 28. 甲乙两种固体的溶解度曲线如右图所示。有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在。现将温度由80℃降到20℃。下列说法错误的是 28. 甲乙两种固体的溶解度曲线如右图所示。有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在。现将温度由80℃降到20℃。下列说法错误的是 A. 杯中固体甲增多、固体乙减少 B. 杯中一定有固体甲而不一定有固体乙 C. 甲和乙的两种溶液仍然是饱和溶液 D. 溶液中溶质甲减少、溶质乙增多 29. 下列是某
30. 一包白色粉末,由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的两种或两种以上的物质混合而成。取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液X。在滤出的白色沉淀中加入足量的盐酸,沉淀全部溶解,并产生无色气体。下列判断错误的是 A. 原白色粉末中一定不含有CuSO4 B. 原白色粉末中一定含有CaCO3 C. 原白色粉末的组成有3种可能 D. 若向无色滤液X中通入二氧化碳,产生白色沉淀,则可推断原白色粉末中一定还含有BaCl2、NaOH 六、填空题(本大题共6小题,每空1分,共15分)。 41. 化学用语可准确、简洁地记录、表达和交流化学信息。请用化学符号填写: (1)4个铜离子 ;(2)食盐水中的溶质 。 42. 漂白粉是常用的消毒剂。其主要成分是氯化钙(CaCl2)和次氯酸钙[Ca(ClO)2],它是白色粉末,具有强烈氯气味,易吸水,化学性质不稳定,遇有机物或遇热可引起燃烧。用于棉织品及纸浆的漂白、污水处理、蔬菜瓜果及自来水消毒、环境卫生等,亦用于制药、脱色等。 (1)次氯酸钙属于 (选填“有机物”或“无机物”)。 (2)根据内容归纳出漂白粉的物理性质 。 (3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出该反应的化学方程式: 。  43. 右图是水分子分解示意图。从示意图中,你能够得出的规律或者结论有(答出两条即可): 43. 右图是水分子分解示意图。从示意图中,你能够得出的规律或者结论有(答出两条即可):(1) ; (2) 。 44. 分类就是按照种类、等级或性质分别归类。依据不同的分类标准,结论也不尽相同。下列每组中有一种物质具有特殊的组成或性质,而其他两种物质的组成或性质相似。请你利用所学知识将其区分出来并说明理由。
45. “地沟油”是人们在生活中对各种劣质油的统称。它在加工过程中需要使用活性炭除臭味、异味,此时活性炭的作用是 。关于“地沟油”的说法有: ①含有大量细菌、真菌等有害微生物和毒素──黄曲霉素等,长期食用可能会引发癌症。 ②辨别某瓶装油是否为“地沟油”的简易方法是看油是否透明;闻油是否有异味;查生产厂家;取油燃烧,听是否发出噼啪响声等。 ③将地沟油和潲水油回收用来炒菜,以达到变废为宝、节约资源的目的。 ④城市的“地沟油”经加工处理后可作为食物油。你认为正确的是 。 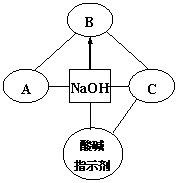 46. 构建知识网络是一种重要的学习方法。下图是关于氢氧化钠化学性质的知识网络, “──”表示相连的两种物质能发生反应,“ ”表示一种物质转化成另一种物质,A、C属于不同类别的化合物。完善这个知识网络: 46. 构建知识网络是一种重要的学习方法。下图是关于氢氧化钠化学性质的知识网络, “──”表示相连的两种物质能发生反应,“ ”表示一种物质转化成另一种物质,A、C属于不同类别的化合物。完善这个知识网络:(1)写出A、B、C的化学式:A ; B ; C 。 (2)写出由NaOH转化成B的化学反应方程式: 。 七、实验与探究题(本大题共2小题,每空1分,共12分)。 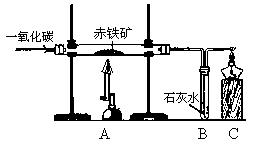 47. 实验室中用CO还原赤铁矿(主要成分为Fe2O3)得到铁,设计的实验装置如下: 47. 实验室中用CO还原赤铁矿(主要成分为Fe2O3)得到铁,设计的实验装置如下: (1)本实验的主要步骤为 (填序号)。 ① 给赤铁矿加热 ② 停止通入一氧化碳 ③ 熄灭酒精喷灯 ④ 通入一氧化碳 (2)写出上述实验过程中发生反应的一个化学方程式: ; 在A装置中观察到的现象是 。 (3)B装置的作用是 。 (4)为防止C处出来的气体污染空气,要进行尾气处理。除了上图中用到的燃烧法外,你还想到其它什么方法?(举一例即可) 。 48. 在一节化学课上,一个精彩的实验探究正在进行:张老师向一支试管中加入氢氧化钠溶液,再逐渐滴加稀盐酸,振荡,使其充分混合。 [提出问题] 氢氧化钠溶液和盐酸混合在一起后,我们并没有观察到明显变化,它们到底发生反应没有呢? [猜想交流] ① 二者没发生反应;② 二者反应了。 [设计方案] 方案一:借助酚酞、石蕊的变色来验证 方案二:通过测溶液的pH来验证 方案三:利用中和反应是放热反应来验证 方案一:甲组同学按右图所示的方法,先向试管中加入约2mL NaOH溶液,再滴入几滴酚酞溶液,溶液变红.然后慢慢滴入稀盐酸,边滴边振荡,看到 ,证明二者发生了反应。 请指出右图操作中的错误: 。 乙组同学向氢氧化钠溶液和盐酸的混合溶液中滴加紫色石蕊溶液,观察到溶液显红色。该组实验能否证明二者发生了反应? 说明理由。 。 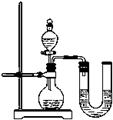 方案二:丙组同学先测出氢氧化钠溶液的pH,然后在滴加稀盐酸的过程中,不断测出混合溶液的的pH,发现混合溶液的pH在不断 ,体现出碱性由强到弱,变成中性,直至显酸性的过程。证明二者发生了反应。若在滴入稀盐酸的过程中,观察到有少量气泡出现,则产生气泡的原因可能是 。 方案二:丙组同学先测出氢氧化钠溶液的pH,然后在滴加稀盐酸的过程中,不断测出混合溶液的的pH,发现混合溶液的pH在不断 ,体现出碱性由强到弱,变成中性,直至显酸性的过程。证明二者发生了反应。若在滴入稀盐酸的过程中,观察到有少量气泡出现,则产生气泡的原因可能是 。方案三:丁组同学在没使用温度计的情况下,通过右图装置完成了实验验证.则U形管中液面的变化情况是 。 你认为最合理的解释是 。 八、计算题(8分)。 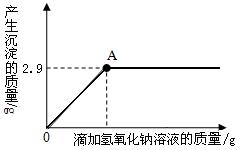 49.有一不纯的白色固体氯化镁中含有少量氯化钠。化学兴趣小组的同学为了测定该固体氯化镁中氯化钠的质量分数。进行了以下实验:称量10g样品置于烧杯中,向其中加入90g水,搅拌,使其完全溶解为止。然后取该溶液一半,往其中滴加10%的氢氧化钠溶液,产生沉淀的质量与所滴入氢氧化钠溶液的质量关系曲线如图所示。试计算:(计算结果保留整数) 49.有一不纯的白色固体氯化镁中含有少量氯化钠。化学兴趣小组的同学为了测定该固体氯化镁中氯化钠的质量分数。进行了以下实验:称量10g样品置于烧杯中,向其中加入90g水,搅拌,使其完全溶解为止。然后取该溶液一半,往其中滴加10%的氢氧化钠溶液,产生沉淀的质量与所滴入氢氧化钠溶液的质量关系曲线如图所示。试计算:(计算结果保留整数)(1)样品中氯化钠的质量分数;(2)当滴入10%的氢氧化钠溶液至A点时,所得溶液中氯化钠的质量分数。 参考答案 一、选择题。(17—30题,每题2.5分,共35分) 17.C 18.D 19.B 20.C 21.B 22. B 23.D 24.C 25.A 26.A 27.C 28.C 29.D 30.C 六、填空题(本大题共6小题,每空1分,共15分)。 41. 4Cu2+NaCl 42.(1)无机物 (2)白色粉末,具有强烈氯气味,易吸水 (3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 43. (1)原子是化学变化中的最小粒子 (2)化学反应前后,元素(或原子)的种类不变 (其它答案正确也可) 44. 不含碳(或氧)元素 (或由两种元素组成) C (其它答案正确也可) 45. 吸附 ①② 46.(1)A: FeCl2 B: Na2CO3C: HCl (H2SO4、HNO3) (2)2NaOH+CO2=Na2CO3+H2O 七、实验与探究题(本大题共2小题,每空1分,共12分)。 47. (1) ④①③②(2)3CO+ 2Fe2O3 高温 4Fe + 3CO2↑ (或 Ca(OH)2 + CO2 = CaCO3 ↓+ H2O2CO + O2 点燃 2CO2 ) 玻璃管里的粉末由红色逐渐变黑 (3)证明有二氧化碳生成 (4)在C处系一个气球(或用塑料口袋)收集尾气。(或在C处用排水集气法收集尾气) 48. 方案一: 红色逐渐消失 胶头滴管伸入到试管中去 不能。因为如果盐酸过量,也能使石蕊溶液变红。(指示剂颜色无变化) 方案二: 减小 可能是氢氧化钠吸收空气中的二氧化碳而变质 方案三: 左低右高中和反应放出的热使烧瓶内气体体积膨胀,压强增大 八、计算题(8分)。 解:根据曲线图可得Mg(OH)2的质量==2.9 g (1分) NaCl的总质量==5.85g +(10-4.75×2)/2g =6.1 g (1分) A点时,所得溶液中NaCl的质量分数==6.1g÷(50+40-2.9)×100%=7% (1分) 答:(略) (注:其他解法只要合理,过程清楚,结果正确均应给分) (责任编辑:admin) |
