|
☆☆☆ 点击下载试题 ☆☆☆ 可能用到的相对原子质量:H-1、C-12、O-16、Fe-56、S-32 时间90分钟分数:100分 I卷(选择题,共60分) 一、单项选择题(本题共有30个小题,每小题2分) 1.下列有关NA的叙述正确的是() A.某无水乙醇与足量金属钠反应生成5.6LH2(标况),则该乙醇分子中共价键总数为4NA B.标况下,22.4L甲烷与22.4L氯气在光照下充分反应,生成的CH3Cl分子数一定为NA C.在密闭容器中加入1.5molH2和0.5molN2,充分反应后得到NH3分子数为NA D.常温常压,56g铁片投入足量浓硫酸中生成SO2分子数为NA 2.下列叙述或实验现象描述正确的是() A.将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸具有酸性 B.往足量铁与稀硝酸反应后的溶液中滴入KSCN溶液,溶液变为血红色 C.往FeSO4溶液中通入NO2气体,溶液始终无明显现象 D.往BaCl2溶液中通入SO2气体,无沉淀产生,再通NH3,产生白色沉淀 3.下列说法正确的是() A.往某溶液中加入稀NaOH溶液,无刺激性气味的气体产生,说明该溶液一定不含NH4+ B.用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl会升华 C.SO2气体和Cl2均能使品红溶液褪色,说明两者均有强氧化性 D.浓硫酸可用来干燥H2、Cl2、SO2等气体,说明浓硫酸具有吸水性 4.可逆反应2N022NO+02在定容密闭容器中反应,达到平衡状态的标志是() ①单位时间内生成nmolO2的同时生成2nmolNO2 ②单位时间内生成nmolO2的同时生成2nmolNO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:l的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态 A、①④⑥B、②③⑤C、①③④D、①②③④⑤⑥ 5.Na2CO3和NaHCO3是金属钠常见的两种碳酸盐,它们广泛地应用于生产和生活中。下列有关碳酸钠和碳酸氢钠的说法中,不正确的是() A.NaHCO3能中和胃酸,对胃壁不产生强烈的刺激或腐蚀作用,可用于治疗胃酸过多症,但不适合胃溃疡病人 B.NaHCO3能中和面粉发酵后产生的酸,并且产生二氧化碳气体,可用于做馒头 C.Na2CO3溶液中混有NaHCO3时,用给溶液加热的方法不能除去 D.往Na2CO3饱和溶液中通入CO2气体,可获得NaHCO3沉淀,由此可说明Na2CO3的溶解度比NaHCO3大 6.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。 反应过程的示意图如下: 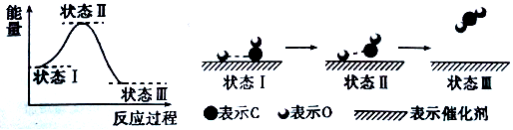 下列说法正确的是() A.CO和O生成CO2是吸热反应B.在该过程中,CO断键形成C和O C.CO和O生成了具有极性共价键的C02D.状态I→状态Ⅲ表示CO与O2反应的过程 7.一定条件下在2L的密闭容器中充入2molSO2和2mol02,发生反应:2SO2(g)+O2(g)2SO3(g),进行到4min时,测得n(SO2)=1.2mol。下列说法正确的是() A.反应进行到2min时,容器中n(SO3)可能为0.5mol B.当v(SO2):v(O2):v(S03)=2:1:2时该反应达平衡状态 C.温度升高时正反应速率增大,逆反应速率减小 D.4min内氧气的平均反应速率为0.5mol/(L·min) 8.可逆反应aA(?)+2B(g)2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是() 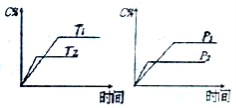 A.达到平衡后,加入催化剂,则C%增大 B.达到平衡后,若升高温度,平衡向右移动 C.a可以为任意的正整数 D.达平衡后,增加A的量,有利于平衡向右移动 9.如图所示,一定条件下将lmolA气体和3molB气体充入一个体积可变的密闭容器中,可滑动活塞的位置图1所示。在恒温恒压下发生A(g)+3B(g)2C(g),当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率为() 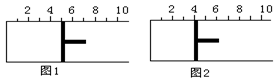 A.20%B.40%C.50%D.无法确定 10.将BaO2放入密闭的真空容器中,反应2BaO2(s)2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是() A.平衡常数减小 B.BaO量不变 C.氧气压强不变 D.BaO2量增加 11.室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s)=CuSO4(s)+5H2O(l),热效应为△H3.则下列判断正确的是( ) A.△H2>△H3B.△H1<△H3C.△H1+△H3=△H2D.△H1+△H2>△H3 12.一定条件下,对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断不正确的是( ) A.c1:c2=1:3 B.平衡时,Y和Z的生成速率之比为2:3 C.X、Y的转化率相等 D.c1的取值范围为0mol·L-1<c1<0.14mol·L-1 13.25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)Pb(s)+Sn2+(aq),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。 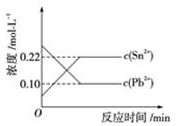 下列判断正确的是() A.往平衡体系中加入金属铅后,c(Pb2+)增大 B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 C.25℃时,该反应的平衡常数K=2.2 D.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 14.已知:C(s)+H2O(g)=CO(g)+H2(g)ΔH=akJ/mol 2C(s)+O2(g)=2CO(g)ΔH=-220kJ/mol H-H、O=O和O-H键的键能分别为436、496和462kJ•mol-1,则a为( ) A.-332B.-118C.+350D.+130 15.由反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是() 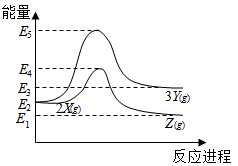 A.由X→Y反应的△H=E5-E2 B.由X→Z反应的△H>0 C.降低压强有利于提高Y的产率 D.升高温度有利于提高Z的产率 16.对于可逆反应2AB3(g)2A(g)+3B2(g)△H>0,下列图象不正确的是() 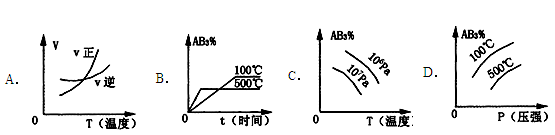 17.在其它条件一定时,图中曲线表示反应2NO(g)+O2(g)2NO2(g)△H>0,达到平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达到平衡状态且V(正)>V(逆)的点是 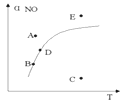 A.A或EB.B点C.C点D.D点 18.可逆反应mA(g)+nB(g)pC(g)+gD(g)的v-t图像如图甲所示, 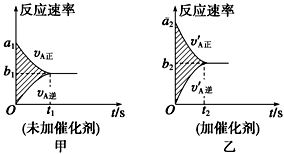 ,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图所示。①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2⑤t1=t2⑥t1>t2 ⑦两图中阴影部分面积相等 ⑧图乙中阴影部分面积更大以上所列正确的为( ) A.②④⑤⑦B.②④⑥⑧C.①③⑤⑦D.①③⑥⑧ 19.下列说法正确的是() A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的 B.升高高温度或加入催化剂,可以改变化学反应的反应热 C.据能量守恒定津,反应物的总能量一定等于生成物的总能量 D.物质发生化学变化一定伴随着能最变化 20.己知下列反应的能量变化示意图如下,下列有关说法正确的是() 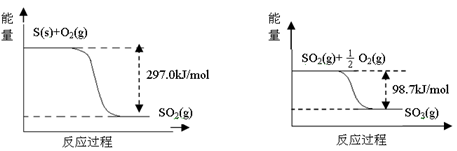 A.1molS(g)与O2(g)完全反应生成SO2(g),反应放出的热量<297.0kJ B.在相同条件下,SO3(g)比SO2(g)稳定 C.1molSO2(g)和1/2molO2(g)生成1molSO3(g)放出98.7kJ的热量 D.由图得S(s)+3/2O2(g)SO3(g)△H=-198.3kJ/mol 21.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应: mX(g)  下列说法正确的是() A.m>nB.温度不变,压强增大,Y的质量分数减少 C.Q<0D.体积不变,温度升高,平衡向逆反应方向移动 22.反应CO(g)+H2O(g)CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率下列措施中正确的是() A.增加压强B.降低温度C.增大CO的浓度D.使用催化剂 23.己知可逆反应SiF4(g)+2H2O(g)Si02(s)+4HF(g),若只改变一个条件使上述反应的化学平衡常数变大,则下列说法错误的是() A.一定向正反应方向移动B.可能是减小压强造成的 C.一定是升高温度造成的D.SiF4的平衡转化率一定增大 24.下列事实不能用勒夏特列原理解释的是() A.光照新制的氯水时,颜色变浅,溶液的酸性增强 B.打开可乐瓶,有大量气泡从溶液中冒出 C.I2(g)+H2(g)2HI(g)的平衡体系,加压后颜色变深 D.高压有利于SO2和O2反应生成S03 25.反应N2O4(g)2NO2(g)△H=+57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是() 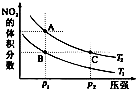 A.a、c两点的反应速率:a>c B.a、c两点气体的颜色:a深,c浅 C.由状态b到状态a,可以用加热的方法 D.a、c两点气体的平均相对分子质量:a>c 26.下列叙述不正确的是() A.对于C(s)+H20(g)CO(g)+H2(g)反应,在一定条件下达到平衡,增加或减少C(s)的量平衡不移动 B.对于2SO2(g)+O2(g)2S03(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志 C.对于C(s)+CO2(g)2CO(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均能作为达到化学平衡状态的标志 D.对于I2(g)+H2(g)2HI(g)反应,加入催化剂或增大压强均能缩短达到平衡所用时间,但HI的百分含量保持不变 27.对于平衡体系:mA(g)+nB(g)pC(g)+qD(g),下列判断正确的是() A.若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45倍,则m+n>p+q B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n C.若升高平衡体系的温度,达到新平衡时A的浓度变为原来的0.55倍,说明该反应△H<0D.若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小 28.已知图一表示的是可逆反应CO(g)+H2(g)C(s)+H20(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)N2O4(g)△H<0的浓度(c)随时间t的变化情况。下列说法中正确的是() 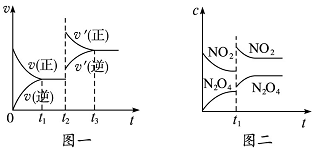 A.图一t2时改变的条件可能是升高了温度或增大了压强 B.若图一t2时改变的条件是增大压强,则反应的△H增大 C.图二t1时改变的条件可能是升高了温度或增大了压强 D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 29.下列四种情况不能用下图图像表示的是() 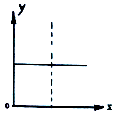 A.N2(g)+3H2(g)2NH3(g),恒容充入He,N2的转化率与时间的关系 B.CH4(g)+H2O(g)CO(g)+3H2(g);ΔH>0,平衡后CH4的物质的量与△H的关系 C.FeCl3+3KSCNFe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl—)与正反应速率关系 D.H2(g)+I2(g)2HI(g),平衡后缩小容器容积,速率与时间的关系 30.已知某化学反应的平衡常数表达式为K=
下列有关叙述不正确的是 A.该反应的化学方程式是:CO(g)+H2O(g)CO2(g)+H2(g) B.上述反应的正反应是放热反应 C.如果在一定体积的密闭容器中加入CO2和H2各1mol,5min后温度升高到830℃,此时测得C为0.4mol时,该反应为平衡状态 D.某温度下,如果平衡浓度符合下列关系式,判断此时的温度是1000℃ II卷(40分) 31.(12分)为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下 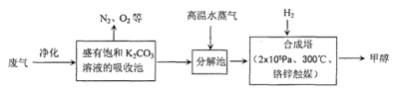 (1)合成塔中反应的化学方程式为;△H<0。从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了。 (2)从合成塔分离出甲醇的原理与下列操作的原理比较相符(填字母) A.过滤B.分液C.蒸馏D.结晶 32.(10分)研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验: 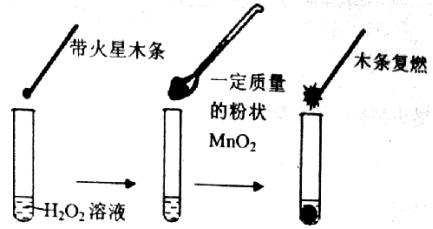 (1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验______(填“能”或“不能”)达到目的,原因是_____。(若能,不必回答原因) (2)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2)  由此得到的结论是____,设计实验Ⅲ的目的是____。 (3)在上述实验过程中,分别检测出溶液中有二价铁生成,查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是_____和_____(按反应发生的顺序写)。 33. 计算题(7分)(相对原子质量:C—12H—1O—16N—14) 蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收。丙氨酸(化学式为C3H7O2N)是其中的一种,请回答下列问题 (1)丙氨酸的相对分子质量是。 (2)一个丙氨酸分子中含有个原子。 (3)丙氨酸分子中各元素的质量比。 (4)356g丙氨酸中含氮元素的质量多少克?(写出计算过程) 34.(10分)反应aA(g)+bB(g)cC(g)△H<0在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示: 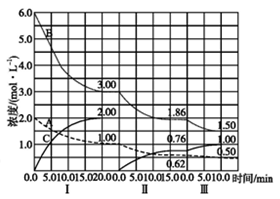 (1)反应的化学方程式中,a:b:c为_______; (2)由第一次平衡到第二次平衡,改变的条件是_____; (3)由第二次平衡到第三次平衡,改变的条件是_____; (4)第II阶段B的平衡转化率aII(B)=______; (5)三次平衡时平衡常数KI、KII、KIII的大小顺序为_______。 (责任编辑:admin) |
