|
☆☆☆ 点击下载试题 ☆☆☆ 2017雅安中考化学试题(含答案) 一、选择题 ( 本大题共 12 个小题, 每小题 3 分; 每小题只有一个选项符合题意, 多选、错选均不给分。) 1. 下列能量的转化中, 不属于物理变化的是 A. 太阳能热水器提供热水B. 水力发电 C. 燃烧天然气做饭D. 电取暖器取暖 2. 下列物质属于混合物的是 A.液氢B. 冰水混合物C. 干冰D. 生铁 3. 智能手机是一种多功能通讯工具, 一款智能机通常含有 41 种以上的化学元素。手机屏幕大部分用的是硅酸铝玻璃, 下列关于硅酸铝玻璃性质的推测正确的是 A.透光性好 C. 易溶于水D. 见光易分解 4. 将变瘪的乒乓球放在热水中能恢复原状, 用分子的观点解释合理的是 A. 分子质量增大B. 分子个数增多 C. 分子间间隔变大D. 分子体积变大 5. 下列化学用语关于数字“3”的意义, 说法正确的是 ①3Hg②Fe3 +③S03④3H2 O A. 表示分子个数的是③ B. 表示离子所带电荷数的是② C. 表示原子个数的是④ D. 表示一个分子中含有某种原子个数的是①  6. 目前, 许多烧烤店都改用机制炭作燃料, 引燃机制炭可以使用固体酒精, 盖灭机制炭可以使用炭灰, 下列有关说法错误的是 A. 酒精的燃烧会升高机制炭的着火点 B. 炭灰可以隔绝空气而使机制炭熄灭 C. 酒精的燃烧 D. 机制炭做成空心可以增大与空气的接触面积 7. 含磷的洗涤剂因含有 Na5 P3 O10 易造成水生植物大量繁殖而污染环境, 因此提倡使用无磷洗涤剂。下列化合价在 Na5 P3 O10 中没有出现的是 A. - 2B.+1C.+4D.+ 5 8. 下列物质的性质与用途对应的是 A. 氧气具有可燃性, 可用于潜水、航天 B. 金刚石是天然最硬的物质, 可用于切割大理石 C. 氮气的化学性质不活泼, 可用于制造硝酸和氮肥 D. 一氧化碳具有可燃性, 可用于冶金工业 9. 下图是生活中常见洗涤用品的 pH, 混用会降低去污效果的组合是 A. 洁厕灵和消毒液B. 肥皂水和炉具清洁剂 C. 消毒液和肥皂水D. 消毒液和炉具清洁剂 10. 高氯酸钾( KClO4 ) 可用作火箭推进剂, 其溶解度如下表。下列说法不正确的是
A. 高氯酸钾的溶解度随温度降低而减小 B. 20℃时, 将 2g 高氯酸钾溶于 98g 水中, 所得溶液中溶质的质量分数小于 2% C. 60℃时, 高氯酸钾饱和溶液中溶质的质量分数小于 7. 3% D. 80℃的高氯酸钾溶液冷却至 40℃肯定有晶体析出 11. 下列反应的化学方程式正确的是 A. 铁在氧气中燃 B. 硫酸铵与烧碱混合:( NH4 ) 2 SO4 +2NaOH=Na2SO4 +2H2 O +2NH3 ↑ C. 铝片放入硝酸银溶液中: Al + AgNO3=AlNO3 + Ag D. 向氯化镁溶液中滴入硫酸钾溶液:MgCl2 + K2 SO4=MgSO4 ↓ + 2KCl 12.下列有关说法正确的是 A. 用酚酞溶液可以一次性鉴别稀硫酸、氢氧化钙溶液和氯化钠溶液 B. 酸和碱反应生成盐和水。物质 M 能与酸反应生成盐和水,M 就是碱 C. 除去氢氧化钠溶液中混有的氢氧化钡, 滴入适量的稀硫酸[来源:ZXXK] D. 将 Zn 和 Ag 分别放入 CuSO4 溶液中, 可以比较 Zn、Cu、Ag 的金属活动性 第Ⅱ卷 ( 非选择题 共 54 分) 注 (1) 包饺子的食材有面粉、韭菜、瘦肉、植物油、食盐等。其中富含糖类的是 ▲ , 不属于有机物的是 ▲ 。 (2) 老年人缺 ▲ 会发生骨质疏松, 容易骨折。 (3) 塑料盆、铁锅, 陶瓷茶杯等是生活常见用品, 其中属于有机合成材料的是 ▲ 。 (4) 活性炭能除去家庭装修中产生的有害气体, 这是利用了活性炭的 ▲ 性。 (5) 加了洗涤剂的水能除去衣服上的油污, 是利用了洗涤剂的 ▲ 作用。 (6) 下列关于水的说法错误的是 ( ) A. 煮沸可以将硬水转化为软水 B. 工业废气直接排放会造成水污染 C. 寻找合适的催化剂, 利 D. 大量使用农药、化肥能提高农作物产量, 不会造成水污染 (7) 过氧化 (8) 某注射用药液的配制方法如下: ①把 1. 0g 药品溶于水配制成 4. 0mL 溶液 a; ②取 0. 1mL 溶液 a, 加水稀释至 1. 0mL, 得溶液 b; ③取 0. 1mL 溶液 b, 加水稀释至 1. 0mL, 得溶液 c; ④取 0. 4mL 溶液 c, 加水稀释至 1. 0mL, 得溶液 d。 由于在整个配制过程中药液很稀, 其密度都可近似看做 1g/cm3 ,1g 该药品可配制溶液 d 的体积是 ▲ mL。 14. (本题共7分) 在宏观、微观和符号之间建立联系是化学的特点。 工业上生产尿素[ CO ( NH2 ) 2 ] 的反应微观示意图如下: 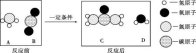 (1) 从微观角度看, 上图中四种物质都是由 ▲ 构成。 (2) 从宏观的角度看, 上图四种物质中属于氧化物的有 ▲ ( 填字母序号) 。 (3) 写出工业上生产尿素的化学方程式 ▲ 。 (4) 锂是一种活动性比铁强的金属, 化学式为 Li, 锂原子结构示意图为 15. (本题共9分) 钛和钛合金被认为是 21 世纪的重要金属材料, 他们具有很多优良的性能, 如熔点高, 密度小, 可塑性好等。以钛铁矿 ( 主要成分为 FeTiO3 , 同时含有少量的 Fe2 O3 、FeO等) 为原料制 TiO2 , 再由 TiO2 制金属 Ti 的工艺流程如下: 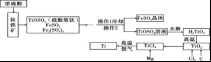 【查阅资料】钛、镁在高温下与空气中的氧气、二氧化碳等反应。 (1) 写出工艺流程中生成硫酸铁的化学方程式 ▲ , 该反应的基本类型是 ▲ 反应。[来源:] (2) 操作 2 的名称是 ▲ 。 (3) 工艺流程中, 水解属于 ▲ 变化。 (4) 工业上常在高温和氩气氛围中, 用金属镁和 TiCl4 反应的方法制备 Ti, 氩气的作用是 ▲ 。 (5)TiO2 可与焦炭、氯气在高温下反应, 该反应中氯气和碳的质量按 71 ∶12 的比例参加反应, 反应的化学方程式为 ▲ 。 16. (本题共9分)某课外兴趣小组设计利用废旧干 纯净、干燥的氢气, 并验证气体中是否含有杂质。实验装置图如下: 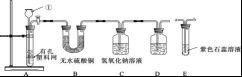 【查阅资料】无水硫酸铜遇水变蓝色 (1) 装置 A 中仪器①的名称是 ▲ ; 写出发生反应的化学方程式 ▲ 。 (2) 实验中看到 B 中无水硫酸铜变蓝色, 说明产生的气体中含有杂质水。为了检验气体中还可能存在的杂质, 可将 E 装置连接到上述装置 ▲ ( 填序号) 之间, 气体从 ▲ (填 a 或 b) 进入装置 E 。 ( (4) 下列收集氢气的方法中符合题意的是 ▲ 。 A. 排水法B. 向下排空气法 C. 干瘪的塑料袋 D. 塑料瓶 17. (本题共 11 分) 馒头、面包等发面食品的一个特点是面团中有许多小孔, 他们使发面食品松软可口。小明学习相关化学知识后, 将家里制作馒头用的白色粉末带到实验室与兴趣小组的同学一起进行探究。 【初步探究】取少量白色粉末于试管中, 加适量水, 测得溶液的 pH >7, 说明溶液呈 ▲ 性。 【提出问题】白色粉末成分是什么? 【查阅资料】 (1) 碳酸钠、碳酸氢钠都可用于制作发面食品。 (2) 碳酸氢钠不稳定, 受热易分解生成二氧化碳和水等; 碳酸钠很稳定。 【猜想与假设】 猜想Ⅰ: 碳酸钠 猜想Ⅱ: 碳酸氢钠 【实验探究】甲乙兴趣小组设计不同实验方案进行探究。 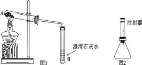 甲组方案: 如图 1, 取适量白色粉末于试管中, 将导管伸入澄清石灰水, 加热, 澄清石灰水变浑浊, 猜想Ⅱ正确。写出装置 B 中反应的化学方程式 ▲ 。 乙组方案: 用如图 2 所示装置作为反应容器, 准确测量生成气体的体积以判断白色粉末的成分。 分别向盛有碳酸钠、碳酸氢钠和白色粉末的锥形瓶中, 注入等体积、等浓度的足量的稀盐酸, 记录如表:
实验①的化学反应方程式为 ▲ ; 表 【反思应用】 (1) 甲组方案中, 无法判断白色粉末是否为碳酸钠和碳酸氢钠的混合物; 乙组方案可以判断, 如果是两者的混合物, 应该满足的条件是 ▲ 。 (2) 家中制作馒头、面包时, 将面粉发酵 ( 产生有机酸) , 再加入适量的碳酸氢钠, 可以使馒头、面包松软。原因是 ▲ 。 18. (本题共 6 分) 化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并 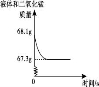 ( 1) 制得氧气的质量是 g。 ( 2) 过氧化氢质量分数是多少? 化学试题参考答案及评分标准 本次阅卷过程中: (1)化学专用名词、化学式书写错误相应给分点不给分。 (2)化学方程式未配平,相应化学方程式不给分。书写化学方程式时,必要的反应条件未写或写错误,要适当扣分。 (3)除提供的答案外,其它合理的回答也参考给分。 第Ⅰ卷 (共36分) 选择题(本大题共12个小题,每小题3分;每小题只有一个选项符合题意,多选、错选均不给分。) 1.C2.D3.A4.C5.B 6.A7.C8.B9.A10.D 11.B12.D 第Ⅱ卷 (共54分) 13.(本题共12分) (1)面粉(1分);食盐(1分) (2)钙/Ca(1分) (3)塑料盆(1分) (4)吸附(1分); (5)2CaO2+2H2O=2Ca(OH)2+O2↑ (2分); (6)乳化(1分); (7)D(2分); (8)1000(2分)。 14.(本题共7分) (1)分子(1分); (2)B、D(2分,选对一个得1分,有错选不得分) (3)2NH3+CO2══CO(NH2)2+H2O(2分); (4)2Li+H2SO4══Li2SO4+H2↑(2分) 15.(本题共9分) (1)Fe2O3+3 H2SO4══Fe2(SO4)3+3 H2O(2分);复分解(1分)。 (2)过滤(1分); (3)化学(1分) (4)防止钛、镁在高温下与空气中的氧气、二氧化碳等反应(2分) (5)TiO2+2Cl2+2C==== TiCl4+2CO(2分) 16.(本题共9分) (1)长颈漏斗 (2)BC(2分),a(1分) (3)浓硫酸 (1分) (4)C(2分); 17.(本题共11分) 【初步探究】碱(1分) 【实验探究】 甲组方案:CO2+Ca(OH)2 ══CaCO3↓+H2O(2分) 乙组方案: Na2CO3+2HCl══2NaCl+CO2↑+H2O(2分) ; a(1分) V3=V2 (2分) 【反思应用】 (1) V1 18.(本题共6分) (1)0.8克(2分) (2)设参加反应的过氧化氢质量为x。 2H2O2 68 32 x 0.8g1分 68∶32=x∶0.8g x=1.7g1分 过氧化氢质量分数:1.7g/ 答:过氧化氢质量分数是2.5%。 (责任编辑:admin) |
||||||||||||||||||||||||||||
