常见的酸
1.生活中常用的酸:胃液中含有的盐酸(HCl),蓄电池中含有硫酸(H2SO4),酸雨中含有的硫酸及硝酸(HNO3),食醋中含有的醋酸(CH3COOH或HAc);饮料中可能含有的碳酸、柠檬酸等。
2.酸的分类:无氧酸(如HCl)、含氧酸(HNO3、H2SO4)等。
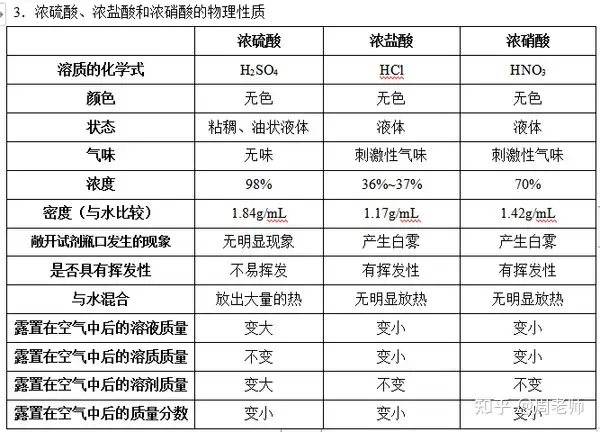
注意:浓硫酸具有一定的特性:
(1)吸水性(物理性质)用于气体干燥,但除NH3等碱性气体除外[2NH3+ H2SO4== (NH4)2SO4]
(2)脱水性(化学性质)——黑面包实验(浓硫酸与蔗糖反应,使之炭化。)
(3)强氧化性,腐蚀性——与金属发生反应,生成的气体不生成氢气而是二氧化硫。
在加热的条件下,能与排在氢后面的金属(如Cu)反应,如:
Cu+2H2SO4(浓)△==CuSO4+SO2↑+H2O
又如,冷的浓硫酸与铁或铝反应后,能生成一层致密的氧化膜,阻止反应进一步进行。
(4)浓硫酸的稀释:酸入水,沿器壁,不断搅拌。
浓硫酸溶于水放出大量的水,足以使水分沸腾,并且水的密度小于浓硫酸的密度。如果把水倒入浓硫酸中,水就会浮在浓硫酸上面,溶解时放出大量的热,致使水沸腾而使硫酸液滴向四周飞溅而造成事故。
(5)安全事故的处理:浓硫酸溅到皮肤上后,首先迅速用抹布将其擦拭,然后用大量水冲洗,最后用3%~5%的NaHCO3涂敷。
稀硫酸溅到皮肤上后,应该马上冲洗,因为随着稀硫酸中溶剂的蒸发,也会变成浓硫酸。
4.酸的化学性质
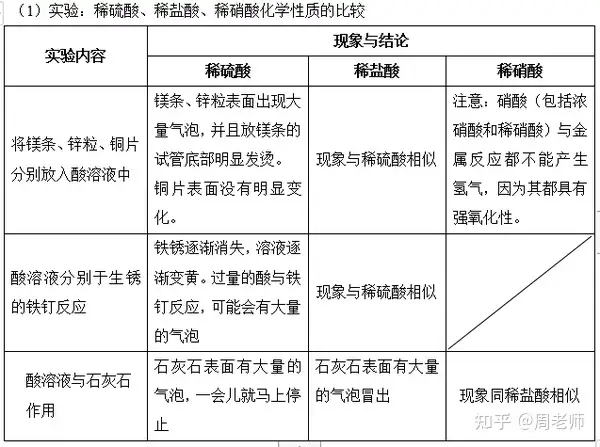
总结:酸所具有的共同特点:
酸在水溶液中都能电离出氢离子,因此酸溶液会具有许多共同的性质(酸的五大通性):
(1)酸溶液与酸碱指示剂的反应
A.紫色石蕊试液或蓝色石蕊试纸遇到酸溶液变红色;
B.无色酚酞试剂遇到酸溶液不变色。
提醒:紫色石蕊试剂变色情况为:“酸红碱蓝”;是指示剂变色,而非待测溶液本身变色。
(2)酸溶液与某些金属反应
酸溶液+ (氢前)金属→ 盐溶液+ 氢气
注意:
A.在金属活动性顺序表中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属则不能;
B.排在金属活动性顺序表越前面的金属,反应现象越剧烈,速度越快,如Mg反应有明显放
热现象;
C.强氧化性酸与金属反应后,不能生成氢气,而是生成水。如浓硫酸、硝酸等强氧化性酸;
D.该类反应属于置换反应
如:Zn + 2HCl == ZnCl2+ H2↑;Fe + H2SO4== FeSO4 + H2↑
(3)酸溶液与某些金属氧化物反应(金属氧化物又称碱性氧化物)
酸溶液+ 金属氧化物→ 盐溶液+ 水
注意:该反应过程中,金属元素的化合价不变,酸中的原子团不变
如:CuO + 2HCl == CuCl2+ H2O;Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O
ZnO + 2HNO3== Zn(NO3)2+H2O
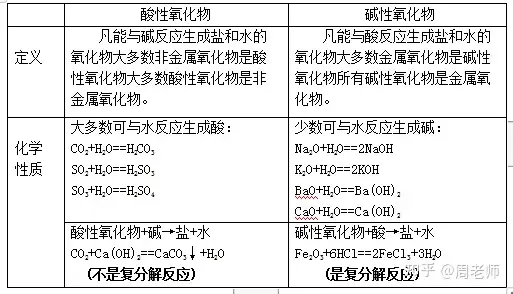
(4)酸溶液与碱的反应(又称为中和反应)
酸+碱→盐+水
(5)酸溶液与某些盐反应
酸溶液+ 盐→ 新酸+ 新盐
注意:A.我们通常遇到的盐是碳酸盐,因此绝大部分反应是:
酸+ 碳酸盐→ 新盐+ 水+ 二氧化碳
如:CaCO3+ 2HCl == CaCl2+ H2O + CO2↑;Na2CO3+ H2SO4== Na2SO4+ H2O + CO2↑;
K2CO3+ 2HNO3== 2KNO3+ H2O + CO2↑;
MgCO3+ CH3COOH == (CH3COO)2Mg + H2O + CO2↑;
B.某些特殊的盐能与酸反应,生成特殊的沉淀
如:HCl + AgNO3== AgCl↓+ HNO3;BaCl2+ H2SO4== BaSO4↓+ 2HCl
补充:Cl-及SO42-的检验
A.向待测溶液中加入AgNO3溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有Cl-,如果没有沉淀或者沉淀消失,则不含有Cl-。
B.向待测溶液中加入Ba(NO3)2溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有SO42-,如果没有沉淀或者沉淀消失,则不含有SO42-。
(责任编辑:admin) |