|
物质的制备、性质和检验 参考答案
1.D 2.A 3.D 4.A 5.D
6.A 7.D 8.B 9.C 10.C
11.A 12.B 13.B 14.D 15.D
16.D 17.C 18.D 19.A 20.C
21.C 22.C 23.B 24.B 25.D
26.D 27.CD 28.AC
29.(1)酒精灯、试管、铁架台、集气瓶、长颈漏斗
(2)A、C E、D E、C
(3)A、B 澄清石灰水变浑浊及试管里固体变红。
30.N2
31.碳酸钙、氧化铜、烧碱。浓硫酸、浓盐酸。浓硫酸、烧碱、浓盐酸
32.Na2CO3、Na2SO4、NaCl
33.Ba(NO3)2、Na2CO3,Na2SO4,NaCl
34.氯化钡、硫酸钡、氯化钠、氯化银、硝酸钠
BaCl2+Na2SO4=BaSO4↓+2NaCl NaCl+AgNO3=AgCl↓+NaNO3
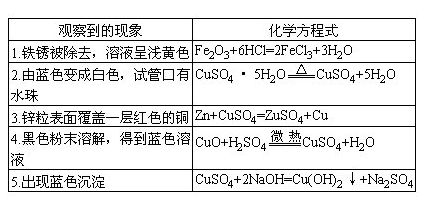
35.
36.(1)石灰水 浓硫酸 稀盐酸
(2)CO,CO2+Ca(OH)2=CaCO3↓+H2O
(3)CO2,CaCO3+2HCl=CaCl2+H2O+CO2↑
(提示:此题是利用CO2和石灰水反应生成CaCO3而除去混合气中的CO2;当不再有CO和CO2的混合气继续进入甲装置时,再打开活塞b,使生成的CaCO3和盐酸反应重新释放出CO2。)
37.(1)EF DC AB JI HG
(2)黑色氧化铜变成红色铜,无水硫酸铜变蓝。
38.(2)分别过滤,得到两种白色固体和两种无色溶液。
(3)将所得固体分别置于两支试管中。若取溶液甲滴入两支试管中,观察到一支试管中产生无色气体,另一支试管中无明显现象。证明甲是稀硫酸,乙是碳酸钠溶液。若取溶液甲滴入两支试管,观察到两支试管中,均无明显现象。证明甲是碳酸钠溶液,乙是稀硫酸。
39.14.7%
(责任编辑:admin)
|