|
☆☆☆ 点击下载试题 ☆☆☆ 由于格式问题此试题可能会出现乱码的情况 为了方便您阅读请点击右上角的全屏查看 2018广元市中考化学冲刺试题 一、单项选择题(本题包括8个小题,每小题3分,共24分) 1.下列关于物质的变化或物质的性质判断正确的是( ) A.生石灰变成熟石灰是物理变化 B.干冰升华是化学变化 C.蔗糖易溶于水是蔗糖的物理性质 D.铜能导电是铜的化学性质 2.对下列现象的解释错误的是( ) A.5ml水与5ml酒精混合后总体积小于10ml,是因为分子与分子之间有间隔 B.不同的花儿香味不同,是因为不同的分子性质不同 C.打开汽水瓶盖后有大量气体从汽水中冒出,是因为气体的溶解度随压强的减小而减小 D.煤粉比煤块容易燃烧,是因为煤粉的着火点低于煤块的着火点 3.化学与生活密切相关,下列生活中的一些做法不可行的一组是( ) A.用布袋代替塑料袋以防止白色污染;扫地前洒水以减少空气中的烟尘含量 B.用过滤的方法降低水的硬度;用水浇灭电线着火 C.用涂油的方法防止铁制品生锈;用升温方法加速蔗糖溶解 D.用小苏打水治疗胃酸过多;蚊虫叮咬后,涂纯碱溶液减轻疼痛 4.(广元市中考化学)下列关于化学中“一定”的说法完全正确的一组是( ) A.分子一定由原子构成;原子核一定由质子和中子构成 B.碱中一定含有氢元素;有机物中一定含有碳元素 C.纯净物一定由同种分子构成;生成盐和水的反应一定是中和反应 D.冷却热饱和溶液一定会有晶体析出;当可燃物的温度达到其着火点就一定会燃烧 5.化学是一门以实验为基础的科学,下列实验操作或实验方案不合理的是( ) A.用燃烧实验可区分天然纤维和合成纤维 B.用干燥的PH试纸可测定某溶液的酸碱度 C.H2与O2的混合气体,可通过灼热的铜网除去混合气体中的O2 D.用Ba(OH)2可区别Na2CO3、Cu(NO3)2、CuSO4、NaCl四种物质 6.关于反应C+2H2SO4(浓) A.X气体排放到空气中,会造成空气污染 B.该反应说明了碳具有还原性,浓硫酸具有氧化性 C.硫酸中硫元素与氧元素的质量比为1:2 D.硫元素的化合价在化学反应前后没有发生改变 7.下列各组物质两两之间都能互相发生化学反应的是( ) A.C CuO H2SO4(稀) B.Ba(OH)2 HCl(稀) K2CO3 C.Fe HCl(稀) CuSO4 D.CO2 Ca(OH)2 HCl(稀) 8.在反应2A+3B=2C+4D中,A与B的相对分子质量之比为1:1,用一定质量的A与12克B恰好完全反应,生产11克C,则下列说法中错误的是( ) A.若A的相对分子质量是32,则C的相对分子质量是88 B.B与D的相对分子质量之比是16:9 C.同时生成D的质量是9克 D.反应中,A与C的质量之比是8:11 二、填空题(本题包括4个小题,每空1分,共20分) 9.(1)写出物质的化学式:①氧化铝 ;②锰酸钾 ; (2)写出反应的化学方程式:①甲烷燃烧: ;②用氯化铜溶液处理纸厂废液中的氢氧化钠的反应: . 10.用所学化学知识,回答下列问题: (1)物质是由微粒构成的.构成物质的微粒保持了物质的化学性质,保持水银的化学性质的最小微粒是汞原子,保持氧气的化学性质的最小微粒是 . (2)某金属元素原子的原子核外第四层电子层上有2个电子,则该电子失去2个电子后形成的阳离子的符号是 ,若该原子的原子核中的质子数与中子数相等,则该金属元素对应的氧化物的相对分子质量是 ;若老年人体内缺少该金属元素则可能发生 . (3)将一定质量的Al加入到Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,所得滤液中一定含有的溶质是 (填化学式);铝的化学性质较活泼,但金属铝却有良好的抗腐蚀性能,原因是 ;飞机外壳用的主要材料是硬铝,硬铝属于 填序号. ①有机高分子化合物; ②合金; ③复合材料. (4)地球是我们生存的家园,保护环境就是保护我们人类自己,而老式硫酸厂污染环境十分严重,其尾气中的二氧化硫和三氧化硫会造成酸雨,其废液中的硫酸会造成水体污染,我们可用烧碱溶液处理硫酸厂的尾气,烧碱与三氧化硫反应的化学方程式为: ;我们常用消石灰中和硫酸厂废液中的硫酸,请说出处理硫酸厂废液中的硫酸为什么用消石灰而不用烧碱的原因是 (答一点即可). 11.(广元市中考化学)请根据下列装置图回答问题: 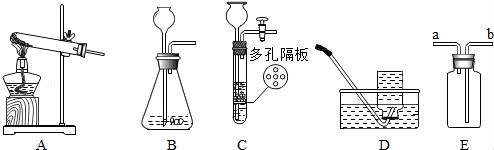 (1)若实验室用A装置制氧气,则反应的化学方程式为: ; (2)装置B或装置C都可用来制二氧化碳,其中装置C的优点是: ; (3)常温下,硫化氢(H2S)是一种有臭鸡蛋气味的气体,易溶于水,水溶液则叫氢硫酸,密度比空气大,实验室常用硫化亚铁(FeS,固体)与稀硫酸发生复分解反应制得,反应的化学方程式为: ,若用E装置收集H2S气体,则H2S气体应从 端通入(填a或b). 12.如图是甲、乙、丙(均不含结晶水)三种物质的溶解度曲线,请据图回答下列问题. (1)在40℃时,甲、乙、丙三种物质的溶解度由大到小的关系是 (物质间用“>”连接); (2)将30℃的三种物质的饱和溶液冷却到20℃后,所得溶液中溶质的质量分数由小到大的关系是: (物质间用“<”连接); (3)现有一定质量的B溶液,将该溶液在50℃下恒温蒸发10克水后析出了2克B晶体,再恒温蒸发5克水后,又析出了2克B晶体,则B物质在50℃时的溶解度是: . 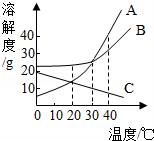 三、推断与探究题(本题包括2个小题,每空1分,共12分) 13.如图所示A~G是初中化学中常见的物质(反应条件和部分产物已省略,“﹣”表示相互能反应,“→”表示转化关系),其中A是人体胃液中含有的酸,B与C的组成元素相同,D是一种红色粉末,F是相对分子质量最小的氧化物.请回答下列问题. (1)写出物质E的一种用途: ; (2)A~G七种物质中,氧化物有 种; (3)F→E的反应现象是 ; (4)A→B反应的基本类型属于: ; (5)F→G的化学方程式是: ;C﹣D反应的化学方程式是: . 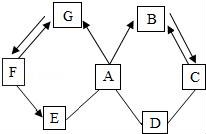 14.(广元市中考化学)在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参与反应且不溶于水)和纯碱为原材料制取烧碱,其制取流程如图:  (1)写出加入纯碱溶液后发生反应的化学方程式: ; (2)[问题与发现]固体A是纯净的氢氧化钠吗? [猜想与假设]根据反应原理,同学们提出以下猜想: 甲的猜想:A是纯净的氢氧化钠固体. 乙的猜想:A是氢氧化钠和氢氧化钙的混合物. 你的猜想: . [实验验证]
[反思与评价]同学们讨论后,认为甲的结论不一定成立,原因是 . 四、计算题(本题一个小题,共4分) 15.有碳酸镁与氧化镁的混合物共重12.4克,把该混合物加入到192克稀盐酸中恰好完全反应,称得反应后溶液的质量为200克.试计算反应后所得溶液中溶质的质量分数.(写出具体计算过程) 广元市中考化学参考答案与试题解析 一、单项选择题(本题包括8个小题,每小题3分,共24分) 1.下列关于物质的变化或物质的性质判断正确的是( ) A.生石灰变成熟石灰是物理变化 B.干冰升华是化学变化 C.蔗糖易溶于水是蔗糖的物理性质 D.铜能导电是铜的化学性质 【考点】化学变化和物理变化的判别;化学性质与物理性质的差别及应用. 【分析】化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;如果需要通过化学变化表现出来就属于物质的化学性质.如果不需要通过化学变化表现出来就属于物质的物理性质;据此分析判断. 【解答】解:A、生石灰变成熟石灰过程中有新物质生成,属于化学变化. B、干冰升华过程中只是状态发生改变,没有新物质生成,属于物理变化. C、蔗糖易溶于水,不需要通过化学变化表现出来,属于物理性质. D、铜能导电,不需要通过化学变化表现出来,属于物理性质. 故选C. 2.对下列现象的解释错误的是( ) A.5ml水与5ml酒精混合后总体积小于10ml,是因为分子与分子之间有间隔 B.不同的花儿香味不同,是因为不同的分子性质不同 C.打开汽水瓶盖后有大量气体从汽水中冒出,是因为气体的溶解度随压强的减小而减小 D.煤粉比煤块容易燃烧,是因为煤粉的着火点低于煤块的着火点 【考点】利用分子与原子的性质分析和解决问题;气体溶解度的影响因素;燃烧与燃烧的条件. 【分析】根据分子的基本特征:分子之间有间隔;同种物质的分子性质相同,不同物质的分子性质不同;气体的溶解度随压强的减小而减小;着火点是物质的属性,结合事实进行分析判断即可. 【解答】解:A、5mL酒精和5mL水混合后体积小于10mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,故选项解释正确. B、不同的花儿有不同的香味,是因为它们是由不同种分子构成的,不同种的分子性质不同,故选项解释正确. C、打开汽水瓶盖时,有大量气泡冒出,说明气体的溶解度随压强的减小而减小,故选项解释正确. D、着火点是物质的属性,一般不变,故选项解释错误. 故选:D. 3.化学与生活密切相关,下列生活中的一些做法不可行的一组是( ) A.用布袋代替塑料袋以防止白色污染;扫地前洒水以减少空气中的烟尘含量 B.用过滤的方法降低水的硬度;用水浇灭电线着火 C.用涂油的方法防止铁制品生锈;用升温方法加速蔗糖溶解 D.用小苏打水治疗胃酸过多;蚊虫叮咬后,涂纯碱溶液减轻疼痛 【考点】(广元市中考化学)白色污染与防治;防治空气污染的措施;硬水与软水;影响溶解快慢的因素;金属锈蚀的条件及其防护;常用盐的用途;灭火的原理和方法. 【分析】A、根据防治白色污染和烟尘的措施进行分析判断. B、根据过滤的原理和灭火的方法分析判断. C、根据防锈的方法和溶解的特点判断. D、根据酸碱中和反应分析判断. 【解答】解:A、用布袋代替塑料袋,可以减少使用不必要的塑料制品,能减少白色污染;扫地前洒水以减少空气中的烟尘含量,故正确. B、过滤只能除去水中的不溶性杂质,不能降低水的硬度;用水浇灭电线着火,会造成触电危险,故错误; C、涂油的方法可隔绝空气和水,从而防止铁制品生锈;温度升高加速蔗糖分子的运动,使蔗糖溶解加速,故正确; D、碳酸氢钠能与胃液中的盐酸反应,可以用小苏打治疗胃酸过多症;蚊虫叮咬后会释放出酸性物质,所以涂一些含碱性物质的溶液止痒,故正确. 故选B. 4.下列关于化学中“一定”的说法完全正确的一组是( ) A.分子一定由原子构成;原子核一定由质子和中子构成 B.碱中一定含有氢元素;有机物中一定含有碳元素 C.纯净物一定由同种分子构成;生成盐和水的反应一定是中和反应 D.冷却热饱和溶液一定会有晶体析出;当可燃物的温度达到其着火点就一定会燃烧 【考点】分子和原子的区别和联系;晶体和结晶的概念与现象;中和反应及其应用;纯净物和混合物的概念;氧化物、酸、碱和盐的概念;有机物的特征、分类及聚合物的特性;原子的定义与构成;燃烧与燃烧的条件. 【分析】A、根据分子、原子的构成分析判断; B、根据碱、有机物的组成分析; C、根据纯净物的构成;中和反应的定义分析判断; D、根据物质的溶解度随温度的变化和燃烧的条件分析判断. 【解答】解:A、分子一定由原子构成;原子核不一定由质子和中子构成,例如氢原子中没有中子,故A错误. B、碱中一定含有氢元素;有机物中一定含有碳元素,故B正确. C、纯净物不一定由同种分子构成,有的由同种原子构成;生成盐和水的反应不一定是中和反应,例如酸与金属氧化物的反应不属于中和反应.故C错误. D、冷却热饱和溶液不一定会有晶体析出,若物质的溶解度水温度的降低而增大,不会析出晶体;当可燃物的温度达到其着火点不一定会燃烧,还需与氧气接触.故D错误. 故选B. 5.(广元市中考化学)化学是一门以实验为基础的科学,下列实验操作或实验方案不合理的是( ) A.用燃烧实验可区分天然纤维和合成纤维 B.用干燥的PH试纸可测定某溶液的酸碱度 C.H2与O2的混合气体,可通过灼热的铜网除去混合气体中的O2 D.用Ba(OH)2可区别Na2CO3、Cu(NO3)2、CuSO4、NaCl四种物质 【考点】棉纤维、羊毛纤维和合成纤维的鉴别;气体的净化(除杂);溶液的酸碱度测定;酸、碱、盐的鉴别. 【分析】A、根据纤维的成分进行分析解答; B、根据酸碱度的测定方法解答; C、根据物质的性质解答; D、根据物质间反应的实验现象进行分析解答. 【解答】解:A、天然纤维和合成纤维灼烧的气味不一样,可以用燃烧实验可区分天然纤维和合成纤维,正确; B、可以用干燥的pH试纸可测定溶液的酸碱度,正确; C、H2与O2的混合气体在加热时可能产生爆炸,故不能用通过灼热的铜网除去混合气体中的O2,错误; D、能与氢氧化钡反应产生白色沉淀的是碳酸钠,混合无现象的是氯化钠,能与氢氧化钡反应生成蓝色和白色沉淀的是硫酸铜,只生成蓝色沉淀的是硝酸铜,故可以用Ba(OH)2可区别Na2CO3、Cu(NO3)2、CuSO4、NaCl四种物质,正确; 故选C. 6.关于反应C+2H2SO4(浓) A.X气体排放到空气中,会造成空气污染 B.该反应说明了碳具有还原性,浓硫酸具有氧化性 C.硫酸中硫元素与氧元素的质量比为1:2 D.硫元素的化合价在化学反应前后没有发生改变 【考点】质量守恒定律及其应用;浓硫酸的性质及浓硫酸的稀释;空气的污染及其危害;有关元素化合价的计算;元素质量比的计算. 【分析】根据“反应C+2H2SO4(浓) 【解答】解:根据“反应C+2H2SO4(浓) 反应前C原子个数为1、H原子个数为4、S原子个数为2、O原子个数为8,反应后C原子个数为1、H原子个数为4、O原子个数为4,可推测X气体为SO2;故: A、根据分析,X气体为SO2,则X气体排放到空气中,会造成空气污染,故说法正确; B、根据“反应C+2H2SO4(浓) C、根据化学式H2SO4,则可知硫酸中硫元素与氧元素的质量比为32:(16×4)=1:2,故说法正确; D、根据“反应C+2H2SO4(浓) 故选D. 7.下列各组物质两两之间都能互相发生化学反应的是( ) A.C CuO H2SO4(稀) B.Ba(OH)2 HCl(稀) K2CO3 C.Fe HCl(稀) CuSO4 D.CO2 Ca(OH)2 HCl(稀) 【考点】复分解反应及其发生的条件;二氧化碳的化学性质;金属的化学性质;碳的化学性质. 【分析】根据复分解反应发生的条件,若两种物质相互交换成分有沉淀、气体或水生成,则能发生化学反应;位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来;结合碳、二氧化碳的化学性质,进行分析解答. 【解答】解:A、碳具有还原性,能与氧化铜反应生成铜和二氧化碳,碳不与稀硫酸反应,故选项错误. B、氢氧化钡与稀盐酸反应生成氯化钡和水,氢氧化钡与碳酸钾反应生成碳酸钡沉淀和氢氧化钾,稀盐酸与碳酸钾反应生成氯化钾、水和二氧化碳,物质两两之间都能互相发生化学反应,故选项正确. C、铁的金属活动性比氢、铜强,能与稀盐酸发生置换反应生成氯化亚铁和氢气,能与CuSO4溶液发生置换反应生成硫酸亚铁溶液和铜,稀盐酸与硫酸铜交换成分没有沉淀、气体或水生成,不能发生复分解反应,故选项错误. D、二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,二氧化碳与稀盐酸不反应,故选项错误. 故选:B. 8.在反应2A+3B=2C+4D中,A与B的相对分子质量之比为1:1,用一定质量的A与12克B恰好完全反应,生产11克C,则下列说法中错误的是( ) A.若A的相对分子质量是32,则C的相对分子质量是88 B.B与D的相对分子质量之比是16:9 C.同时生成D的质量是9克 D.反应中,A与C的质量之比是8:11 【考点】质量守恒定律及其应用. 【分析】根据“在反应2A+3B=2C+4D中,A与B的相对分子质量之比为1:1”,则可假设A和B的相对分子质量为a,又因为“一定质量的A与12克B恰好完全反应,生产11克C”,则可求一定量A的质量;根据质量守恒定律的质量守恒,可求D的质量. 【解答】解:根据“在反应2A+3B=2C+4D中,A与B的相对分子质量之比为1:1”,则可假设A和B的相对分子质量为a,设A的质量为x,则 A、在反应2A+3B=2C+4D中,A和B的相对分子质量比为1:1.已知“一定质量的A与12克B恰好完全反应,生产11克C”,因为A的质量为8g;若A的相对分子质量是32,则 B、根据分析,若A的相对分子质量是32,B为32,若C的相对分子质量是44,则可计算D的相对分子质量是18,此反应中B与D的相对分子质量之比是16:9,该选项说法正确; C、根据分析,可求D的质量为8g+12g﹣11g=9g,该选项说法正确; D、根据分析,A与C的质量之比是8g:11g=8:11,该选项说法正确. 故选:A. 二、填空题(本题包括4个小题,每空1分,共20分) 9.(广元市中考化学)(1)写出物质的化学式:①氧化铝 Al2O3 ;②锰酸钾 K2MnO4 ; (2)写出反应的化学方程式:①甲烷燃烧: CH4+2O2 【考点】化学式的书写及意义;书写化学方程式、 . 【分析】(1)化合物化学式的书写一般规律:先读后写,后读先写;金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零; (2)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可. 【解答】解:(1)①氧化铝中,铝元素显+3价,氧元素显﹣2价,故其化学式为Al2O3;故填:Al2O3; ②锰酸钾的化学式为K2MnO4;故填:K2MnO4; (2)①甲烷与氧气在点燃的条件下反应生成水和二氧化碳;故填:CH4+2O2 ②氯化铜与氢氧化钠反应生成氯化钠和氢氧化铜沉淀,故填:CuCl2+2NaOH=Cu(OH)2↓+2NaCl. 10.用所学化学知识,回答下列问题: (1)物质是由微粒构成的.构成物质的微粒保持了物质的化学性质,保持水银的化学性质的最小微粒是汞原子,保持氧气的化学性质的最小微粒是 氧分子 . (2)某金属元素原子的原子核外第四层电子层上有2个电子,则该电子失去2个电子后形成的阳离子的符号是 Ca2+ ,若该原子的原子核中的质子数与中子数相等,则该金属元素对应的氧化物的相对分子质量是 40 ;若老年人体内缺少该金属元素则可能发生 骨质疏松症 . (3)将一定质量的Al加入到Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,所得滤液中一定含有的溶质是 Al(NO3)3 (填化学式);铝的化学性质较活泼,但金属铝却有良好的抗腐蚀性能,原因是 通常情况下,铝能和空气中的氧气反应生成一层致密的氧化物薄膜,阻止铝进一步反应 ;飞机外壳用的主要材料是硬铝,硬铝属于 ② 填序号. ①有机高分子化合物; ②合金; ③复合材料. (4)地球是我们生存的家园,保护环境就是保护我们人类自己,而老式硫酸厂污染环境十分严重,其尾气中的二氧化硫和三氧化硫会造成酸雨,其废液中的硫酸会造成水体污染,我们可用烧碱溶液处理硫酸厂的尾气,烧碱与三氧化硫反应的化学方程式为: SO3+2NaOH═Na2SO4+H2O ;我们常用消石灰中和硫酸厂废液中的硫酸,请说出处理硫酸厂废液中的硫酸为什么用消石灰而不用烧碱的原因是 氢氧化钠的价格昂贵 (答一点即可). 【考点】分子的定义与分子的特性;合金与合金的性质;金属的化学性质;碱的化学性质;相对分子质量的概念及其计算;化学符号及其周围数字的意义;书写化学方程式、 ;人体的元素组成与元素对人体健康的重要作用. 【分析】(1)根据金属、大多数固态非金属单质等由原子构成,有些物质是由分子构成的,如水、氢气等,有些物质是由离子构成的,如氯化钠,进行分析解答即可. (2)根据核外电子排布规律,以及离子的书写方法,对原子质量=质子数+中子数,在原子中质子数=核外电子数进行解答; (3)根据反应的生成物、通常情况下,铝能和空气中的氧气反应生成一层致密的氧化物薄膜,硬铝是铝的合金进行解答; (4)根据氢氧化钠俗称烧碱以及化学方程式的书写规则进行解答. 【解答】解:(1)氧气是由氧分子构成的,保持氧气的化学性质的最小微粒是氧分子; (2)根据核外电子排布规律,某金属元素原子的原子核外第四层电子层上有2个电子,可知该金属元素为钙元素,其形成的阳离子符号为:Ca2+;根据相对原子质量=质子数+中子数,已知核外电子为20,则质子数为20,故其相对原子质量为40;老年人缺少钙元素患骨质疏松症; (3)Al会与Cu(NO3)2和AgNO3反应生成硝酸铝,故一定有的溶质为:Al(NO3)3; 铝在空气中却表现出良好的抗腐蚀性能,其原因是:通常情况下,铝能和空气中的氧气反应生成一层致密的氧化物薄膜,阻止铝进一步反应; 硬铝是铝的合金,故选②; (4)氢氧化钠俗称烧碱,三氧化硫与氢氧化钠反应的化学方程式是SO3+2NaOH═Na2SO4+H2O; 除杂除了考虑能够除去以外,还需要考虑成本问题,氢氧化钠的价格昂贵,故不用氢氧化钠除杂. 故答案为:(1)氧分子;(2)Ca2+;40;骨质疏松症;(3)Al(NO3)3;通常情况下,铝能和空气中的氧气反应生成一层致密的氧化物薄膜,阻止铝进一步反应;②;(4)SO3+2NaOH═Na2SO4+H2O;氢氧化钠的价格昂贵; 11.请根据下列装置图回答问题: 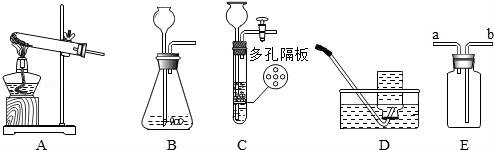 (1)若实验室用A装置制氧气,则反应的化学方程式为: 2KClO3 (2)装置B或装置C都可用来制二氧化碳,其中装置C的优点是: 控制反应的发生与停止 ; (3)常温下,硫化氢(H2S)是一种有臭鸡蛋气味的气体,易溶于水,水溶液则叫氢硫酸,密度比空气大,实验室常用硫化亚铁(FeS,固体)与稀硫酸发生复分解反应制得,反应的化学方程式为: FeS+H2SO4=FeSO4+H2S↑ ,若用E装置收集H2S气体,则H2S气体应从 b 端通入(填a或b). 【考点】常用气体的发生装置和收集装置与选取方法;实验室制取氧气的反应原理;书写化学方程式、 . 【分析】(1)由A装置的特点是加热固体制取气体且试管口没有棉花团,故所选的药品为氯酸钾和二氧化锰去分析; (2)由于装置C可以通过固体和液体的分离与结合来控制反应的发生与停止,而B装置中药品加入后,不能分离,一旦发生就不能控制; (3)(广元市中考化学)硫化亚铁(FeS,固体)与稀硫酸发生复分解反应,由于复分解反应是两种化合物相互交换成分生成另外两种化合物的反应,故生成物为硫化氢和硫酸亚铁,如果用E装置收集硫化氢气体,收集时应从b导管进入. 【解答】解:(1)实验室用A装置制氧气,由A装置的特点是加热固体制取气体且试管口没有棉花团,故所选的药品为氯酸钾和二氧化锰.加热氯酸钾和二氧化锰的混合物,生成氯化钾和氧气,其化学方程式为:2KClO3 (2)由于装置C可以通过固体和液体的分离与结合来控制反应的发生与停止,而B装置中药品加入后,不能分离,一旦发生就不能控制;故C装置的优点是:控制反应的发生与停止; (3)硫化亚铁(FeS,固体)与稀硫酸发生复分解反应,由于复分解反应是两种化合物相互交换成分生成另外两种化合物的反应,故生成物为硫化氢和硫酸亚铁,故反应的化学方程式为:FeS+H2SO4=FeSO4+H2S↑;如果用E装置收集硫化氢气体,收集时应从b导管进入,由于硫化氢的密度比空气大,硫化氢沉积在集气瓶的底部,由下而上,充满集气瓶;故答案为:FeS+H2SO4=FeSO4+H2S↑ b. 12.如图是甲、乙、丙(均不含结晶水)三种物质的溶解度曲线,请据图回答下列问题. (1)在40℃时,甲、乙、丙三种物质的溶解度由大到小的关系是 A>B>C (物质间用“>”连接); (2)将30℃的三种物质的饱和溶液冷却到20℃后,所得溶液中溶质的质量分数由小到大的关系是: C<A<B (物质间用“<”连接); (3)现有一定质量的B溶液,将该溶液在50℃下恒温蒸发10克水后析出了2克B晶体,再恒温蒸发5克水后,又析出了2克B晶体,则B物质在50℃时的溶解度是: 40g . 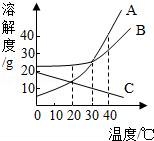 【考点】固体溶解度曲线及其作用;固体溶解度的概念;晶体和结晶的概念与现象;溶质的质量分数、溶解性和溶解度的关系. 【分析】根据已有的溶解度曲线的意义进行分析解答,溶解度随温度升高而增大的物质当升高温度时其溶质质量分数不变;根据溶解度受温度变化的特点确定析出晶体的方法,据此解答. 【解答】解:(1)据图可以看出,在40℃时,甲、乙、丙三种物质的溶解度由大到小的关系是A>B>C,故填:A>B>C; (2)将30℃的三种物质的饱和溶液冷却到20℃后,C的溶解度随温度的降低而增大,故溶液组成不变,溶质质量分数最小,A和B的溶解度随温度的溶解降低而减小,会析出晶体,在20℃时B的溶解度大于A的溶解度,故B的溶质质量分数大于A,故所得溶液中溶质的质量分数由小到大的关系是C<A<B,故填:C<A<B; (3)将B溶液在50℃下恒温蒸发10克水后析出了2克B晶体,形成饱和溶液,再恒温蒸发5克水后,又析出了2克B晶体,说明5g水中最多溶解2gB,故100g水中溶解B的质量为: 三、推断与探究题(本题包括2个小题,每空1分,共12分) 13.如图所示A~G是初中化学中常见的物质(反应条件和部分产物已省略,“﹣”表示相互能反应,“→”表示转化关系),其中A是人体胃液中含有的酸,B与C的组成元素相同,D是一种红色粉末,F是相对分子质量最小的氧化物.请回答下列问题. (1)写出物质E的一种用途: 改良酸性土壤 ; (2)A~G七种物质中,氧化物有 4 种; (3)F→E的反应现象是 放出热量 ; (4)A→B反应的基本类型属于: 复分解反应 ; (5)(广元市中考化学)F→G的化学方程式是: 2H2O 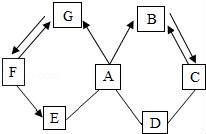 【考点】物质的鉴别、推断;从组成上识别氧化物;反应类型的判定;书写化学方程式、 . 【分析】根据A~G是初中化学中常见的物质,A是人体胃液中含有的酸,所以A盐酸,F是相对分子质量最小的氧化物,所以F是水,D是一种红色粉末,盐酸和D会发生反应,所以D是氧化铁,C会与氧化铁反应,B、C可以相互转化,B与C的组成元素相同,所以C是一氧化碳,B是二氧化碳,盐酸会生成G,G和水可以相互转化,所以G是氢气,水生成的E和盐酸会发生反应,所以E是氢氧化钙,然后将推出的物质进行验证即可. 【解答】解:(1)A~G是初中化学中常见的物质,A是人体胃液中含有的酸,所以A盐酸,F是相对分子质量最小的氧化物,所以F是水,D是一种红色粉末,盐酸和D会发生反应,所以D是氧化铁,C会与氧化铁反应,B、C可以相互转化,B与C的组成元素相同,所以C是一氧化碳,B是二氧化碳,盐酸会生成G,G和水可以相互转化,所以G是氢气,水生成的E和盐酸会发生反应,所以E是氢氧化钙,经过验证,推导正确,所以E是氢氧化钙,可以改良酸性土壤; (2)通过推导可知,A是盐酸,B是二氧化碳,C是一氧化碳,D是氧化铁,E是氢氧化钙,F是水,G是氢气,所以A~G七种物质中,氧化物有4种; (3)F→E的反应是水和氧化钙反应生成氢氧化钙,实验现象是:放出热量; (4)A→B的反应是盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,所以基本反应类型属于复分解反应; (5)F→G的反应是水在通电的条件下生成氢气和氧气,化学方程式是:2H2O 故答案为:(1)改良酸性土壤; (2)4; (3)放出热量; (4)复分解反应; (5)2H2O 14.在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参与反应且不溶于水)和纯碱为原材料制取烧碱,其制取流程如图:  (1)(广元市中考化学)写出加入纯碱溶液后发生反应的化学方程式: Na2CO3+Ca(OH)2=CaCO3↓+2NaOH ; (2)[问题与发现]固体A是纯净的氢氧化钠吗? [猜想与假设]根据反应原理,同学们提出以下猜想: 甲的猜想:A是纯净的氢氧化钠固体. 乙的猜想:A是氢氧化钠和氢氧化钙的混合物. 你的猜想: 氢氧化钠和碳酸钠的混合物 . [实验验证]
[反思与评价]同学们讨论后,认为甲的结论不一定成立,原因是 因为碳酸钠、氢氧化钙的水溶液都显碱性,它们都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠 . 【考点】实验探究物质的组成成分以及含量;碳酸钙、生石灰、熟石灰之间的转化;盐的化学性质;书写化学方程式、 . 【分析】(1)煅烧碳酸钙时,碳酸钙分解能生成氧化钙和二氧化碳;氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠; (2)[猜想与假设]根据反应生成的产物作出猜想; [探究与验证]显碱性的溶液能使酚酞试液变红色,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳,碳酸钠能和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠; [反思与评价]碳酸钠、氢氧化钙的水溶液都显碱性,都能够使酚酞试液变红色; 【解答】解:(1)氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH. (2)[猜想与假设]氧化钙和水反应生成了氢氧化钙,而氢氧化钙可以和碳酸钠反应生成氢氧化钠,若氢氧化钙是过量的,则在反应后的溶液中还含有氢氧化钙,若碳酸钠是过量的,则在反应后的溶液中还含有碳酸钠,即可以作出固体A为氢氧化钠和碳酸钠的猜想; [探究与验证]乙:取少量固体A,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液,如果没有出现白色沉淀,说明氢氧化钠中不含氢氧化钙,猜想不成立. 你:取少量固体A,溶于适量水形成溶液后,滴加足量的稀盐酸;如果有气泡产生,说明氢氧化钠中含有碳酸钠,猜想成立. [反思与评价]根据实验流程,可以判定甲同学设计的方案不严密,理由是:因为碳酸钠、氢氧化钙的水溶液都显碱性,无论碳酸钠过量还是氢氧化钙过量,混有碳酸钠或氢氧化钙的氢氧化钠配成溶液后,都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠,故甲同学设计的方案是错误的. 故答案为:(1)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH. (2)[猜想与假设]氢氧化钠和碳酸钠的混合物. [探究与验证]乙:没有出现白色沉淀. 你:取少量固体A,溶于适量水形成溶液后,滴加足量的稀盐酸;有气泡产生. [反思与评价]因为碳酸钠、氢氧化钙的水溶液都显碱性,它们都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠. 四、(广元市中考化学)计算题(本题一个小题,共4分) 15.有碳酸镁与氧化镁的混合物共重12.4克,把该混合物加入到192克稀盐酸中恰好完全反应,称得反应后溶液的质量为200克.试计算反应后所得溶液中溶质的质量分数.(写出具体计算过程) 【考点】根据化学反应方程式的计算;有关溶质质量分数的简单计算. 【分析】根据题目信息可知,气体是碳酸镁和盐酸反应生成的二氧化碳,而氧化镁和盐酸反应不生成二氧化碳,据此把二氧化碳的质量代入方程式可计算出碳酸镁的质量和氯化镁的质量,并计算出氧化镁的质量;根据算出的氧化镁的质量,然后代入氧化镁和盐酸反应方程式计算出氯化镁的质量,最后算出溶液中溶质的质量分数. 【解答】解:反应生成的二氧化碳的质量为12.4g+192g﹣200g=4.4g 设原混合物中MgCO3的质量为x,与盐酸反应生成MgCl2的质量为y. MgCO3+2HCl═MgCl2+H2O+CO2↑ 84 95 44 x y 4.4g x=8.4g y=9.5g 则氧化镁质量为12.4g﹣8.4g=4g 设MgO与盐酸反应生成MgCl2的质量为z MgO+2HCl═MgCl2+H2O 40 95 4g z z=9.5g ∴反应后所得溶液中溶质的质量=9.5g+9.5g=19g ∴则反应后所得溶液中溶质的质量分数为= 答:反应后所得溶液中溶质的质量分数是9.5% (责任编辑:admin) |
